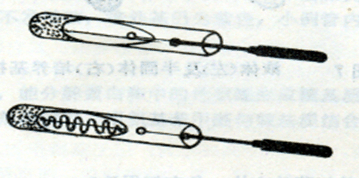
树突细胞的分离-用小鼠骨髓前体细胞培养树突细胞
互联网
3981
实验材料:
1. 6-7周龄小鼠(最好为雄性鼠,因为它们的骨头比较粗大;运输后需要休息至少5天;不要使用应激或脱水的老鼠)
2. 70%乙醇
3. 冰冷的以及室温的RPMI-1640培养基(如Life Technologies)
4. 氯化铵溶液0.02mol/L Tris·Cl,pH7.2 /0.14mol/L NH4 Cl
5. 裂解淋巴细胞的抗体(杂交瘤上清)(可选)。例如,杂交瘤RA3-3A1(B220抗体;ATCC号TIB146)、GK1.5(CD4抗体;ATCC号TIB207)、3.155(CD8抗体;ATCC号TIB211)、M5/114(MHCⅡ抗体;ATCC号TIB120)
6. 兔补体(Pel-Freez)
7. RPMI-5完全培养基
8. 小鼠GM-CSF(mGM-CSF):可以来源于纯化的重组蛋白,也可来源于转染小鼠GM-CSF基因的细胞系的条件培养基
9. 用于流式细胞检测DC的抗体:如MHCⅡ类分子的杂交瘤上清(ATCC号TIB120)、B7-2/CD86的杂交瘤上清(Pharmingen)、DEC-205的抗体(ATCC号HB290)
10. 解剖用品
11. 无菌纱布垫
12. 100mm培养皿(如Falcon)
13. 3ml注射器25G,5/8in(1.58cm)针头
14. 9in(23cm)巴氏吸管(填充棉花并高压灭菌)
15. Nytex滤器(3-40/26;Tetko)
16. 15ml和50ml聚丙烯锥底管
17. 24孔培养板(如Corning)
实验方法:
1. 取小鼠股骨和胫骨,保存在置于冰上的RPMI-1640培养基中,直到所有的小鼠准备完毕。去除骨头上的肌肉(通常在无菌纱布垫操作)后,将干净的骨头置于新的平皿里。然后在含70%乙醇的培养皿里浸泡骨头2min,最后用冷RPMI-1640培养基洗涤2遍。
2. 用剪刀剪去骨的两端(骺)然后将其转移到另外的培养皿中。用注射器吸取2ml RPMI-1640培养基冲洗骨髓腔以获得骨髓。在另一培养皿里剁碎骨骺。将剁碎的骨骺以及从骨髓腔里冲洗出来的骨髓混合在一起,用吸管打碎团块,将悬液通过筛网(去除颗粒)后收于15ml或者50ml的离心管里。
3. 加入3-10ml的氯化铵溶液裂解红细胞。室温静置3min后,室温,280g离心10min(1200r/min Beckman GH-3.7转子),弃上清。
4. 去除淋巴细胞(可选):将细胞配成1×107 个细胞/ml,加入合适浓度的杂交瘤上清(通常1:20终浓度)和兔补体(通常1:17-1:20终浓度)。37℃水浴培养1h,每20min振荡一次。
5. 用RPMI-1640洗涤骨髓细胞2次,室温,280g离心10min。计数活细胞。用RPMI-5完全培养基调整细胞浓度至1×106 个细胞/ml。
6. 加入小鼠重组GM-CSF至终浓度为700-1000U/ml或者20ng/ml。将细胞悬液一般每只小鼠可以得到4×107 -5×107 个骨髓细胞(没有去除淋巴细胞)按1ml/孔接种24孔板。
7. 每2天洗涤细胞一次,每次移出旧的培养基,然后倾斜24孔板用RPMI-1640轻轻地沿孔壁洗涤后吸出洗涤液,最后加入1ml新的含700-1000U/ml(约20 ng/ml)mGM-CSF的RPMI-5完全培养基(步骤6)。
8. 可选:验证聚集物的特征--MHCⅡ类分子存在于不成熟DC的胞内小室(MHCⅡ小室或者MⅡC)通过标记〔3 H〕胸腺嘧啶,可发现10%-20%的细胞处于S期,用流式细胞仪分析,细胞中度表达膜MHCⅡ类分子,但是不表达B7-2/CD86共刺激分子。
9. 在第5-8天期间(此时已产生足够的聚集体),用RPMI-1640或RPMI-5培养基轻轻吹打,将聚集体从贴壁的基质细胞上脱离下来(此后几天一直会有聚集体产生)。收集脱离的细胞,室温,280g离心10min,弃上清。用RPMI-5培养基重悬,最高浓度1×106 个细胞/ml。然后铺在直径为100mm的培养皿中,每个培养皿10ml,最多铺1×107 个细胞。
10. 于细胞转移后24-48h期间,每24h轻轻摇晃培养皿,收集非贴壁、非增殖、成熟的DC,转移至另外的收集管中用于后期的研究。
11. 计数活细胞。用流式细胞仪或者用血细胞计数板计数大的形状不规则的细胞来检测DC得率(每只动物通常获得5×106 -10×106 个细胞,≥60%表达成熟DC的表面标志)。