细胞自噬概念及研究
互联网
55338
什么是自噬?
细胞自噬(autophagy or autophagocytosis):又称为Ⅱ型细胞死亡,是细胞在自噬相关基因(autophagyrelated gene,Atg)的调控下利用溶酶体降解自身受损的细胞器和大分子物质的过程。
比利时科学家Christian de Duve在上世纪50年代经过电镜察看到自噬体(autophagosome)构造,并且在1963年溶酶体国际会议上首先提出了"自噬"这种说法。因而Christian de Duve被公以为自噬研讨的鼻祖。Christian de Duve也因发现溶酶体,于1974年取得诺贝尔奖。
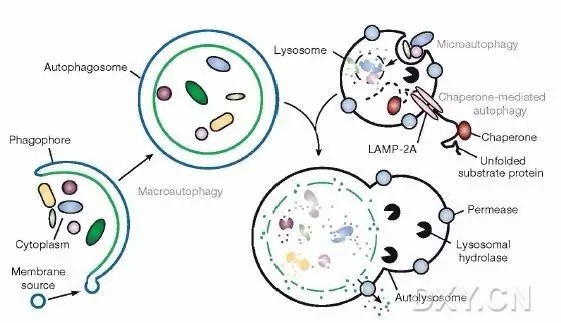
目前根据发生过程分为三类:Macroautophagy,Microautophagy和Chaperone-mediated autophagy CMA)。
大自噬(Macroautophagy)即我们说的自噬(autophagy);
微自噬(Microautophagy):是指溶酶体主动、直接吞噬胞浆成分的一种方式;
分子伴侣介导的自噬(Chaperone-mediated autophagy,CMA):一些分子伴侣,如hsp70,能帮助未折叠蛋白转位入溶酶体。通常说的自噬泛指Macroautophagy.
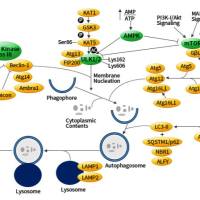
自噬的过程
1)细胞接受自噬诱导信号后,在胞浆的某处形成一个小的类似"脂质体"样的膜结构,然后不断扩张,被称为Phagophore。
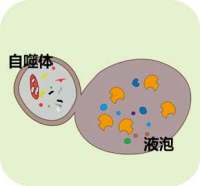
2)Phagophore不断延伸,将胞浆中的任何成分,全部揽入,然后"收口",成为密闭的球状的autophagosome,即"自噬体"。
3)自噬体形成后,可与细胞内吞的吞噬泡、吞饮泡和内体融合(这种情况不是必然要发生的)。
4)自噬体与溶酶体融合形成autolysosome,期间自噬体的内膜被溶酶体酶降解,2者的内容物合为一体,自噬体中的"货物"也被降解,产物(氨基酸、脂肪酸等)被输送到胞浆中,供细胞重新利用,而残渣或被排出细胞外或滞留在胞浆中。
自噬的调控
1. 依赖mTOR(哺乳动物雷帕霉素靶点)途径的自噬
1)PI3K-AKT-mTOR信号通路
2)AMPK-TSC 1/2-mTOR 信号通路
2. 其它的信号通路
1)3-甲基腺嘌呤(3-MA)通过抑制Class ⅢPI3K的活性抑制自噬。
2)beclin1和UVRAG作为正调控子,抗凋亡因子bcl-2作为负调控子共同参与组成Class ⅢPI3 复合物调控自噬。
3)GTP结合的G蛋白亚基Gαi3抑制自噬;GDP结合的Gαi3蛋白活化自噬。
4)死亡相关蛋白激酶(death-associated proteinlinase,DAPK)和DAPK相关蛋白激酶(DAPK-related protein kinase-1,DRP-1)诱导自噬。
5)PKA、casein激酶 Ⅱ、MAP激酶、calcium途径也在自噬错综复杂的调控网格中,但其机制还不甚清楚。
自噬与疾病
1. 自噬与代谢
自噬能清除不正常构型的蛋白质,并消化受损和多余的细胞器,是真核细胞中广泛存在的降解/再循环系统。
在细胞新陈代谢、结构重建、生长发育中起着重要作用。
在饥饿和新生儿早期,自噬作用明显加强,自噬体显著增多。
2. 自噬与肿瘤
细胞自噬与肿瘤的关系十分复杂,目前尚未完全阐明。
一方面,正常细胞自噬增强,可表现出抑制肿瘤发生的功能;与此相反,抑制细胞自噬有潜在的致瘤可能。
另一方面,肿瘤细胞也可通过增强细胞自噬来对抗由缺氧、代谢产物、治疗药物诱导的应激反应。
细胞自噬研究
细胞自噬的研究是目前生物医学领域热点之一,广泛参与各种生理和病理过程。目前普遍采用的自噬检测方法包括电镜、免疫荧光、蛋白质印迹等方法检测自噬体及其标志蛋白。
正常培养的细胞自噬活性很低,不适于观察,因此,必须对自噬进行人工干预和调节,通常使用的工具药有:
自噬诱导剂
(1) Bredeldin A / Thapsigargin / Tunicamycin :模拟内质网应激
(2) Carbamazepine/ L-690,330/ Lithium Chloride(氯化锂):IMPase抑制剂(即Inositol monophosphatase,肌醇单磷酸酶)
(3) Earle's平衡盐溶液:制造饥饿
(4) N-Acetyl-D-sphingosine(C2-ceramide):Class I PI3K Pathway抑制剂
(5) Rapamycin:mTOR抑制剂
(6) Xestospongin B/C:IP3R阻滞剂
自噬抑制剂
(1) 3-Methyladenine(3-MA):(Class III PI3K)hVps34 抑制剂
(2) Bafilomycin A1:质子泵抑制剂
(3) Hydroxychloroquine(羟氯喹):Lysosomal lumen alkalizer(溶酶体腔碱化剂)
自噬过程的检测
目前,人们对自噬的检测主要包括基于检测自噬体的直接(观察自噬体的形态)和间接(检测自噬体表面蛋白标记)的方法以及基于自噬性降解原理设计的一些方法。除此之外,还可通过对自噬通路的调控来全面评价自噬功能对细胞行为或机体功能的影响,如自噬抑制或激活剂、自噬相关基因的敲除及沉默等。
除了电镜下的形态学观察外,自噬体标记蛋白LC3的检测是目前常用的方法,在荧光显微镜下采用GFP-LC3融合蛋白来示踪自噬形成,更有mRFP-GFP-LC3双标蛋白的自噬检测等。
双荧光LC3细胞自噬腺病毒
mRFP 用于标记及追踪LC3,GFP 的减弱可指示溶酶体与自噬小体的融合形成自噬溶酶体,即由于GFP荧光蛋白对酸性敏感,当自噬体与溶酶体融合后GFP 荧光发生淬灭,此时只能检测到红色荧光。
我们在显微镜成像后红绿荧光merge后通过merge后出现的黄色斑点即只是自噬体.红色的斑点指示自噬溶酶体,通过不同颜色斑点的计数可以清晰的看出自噬流的强弱。
如下图:细胞转染mRFP-GFP-LC3病毒后给予氨基酸剥夺处理2小时后出现明显增强的自噬以及自噬流。
红色斑点是自噬溶酶体(mRFP),黄色斑点是自噬体(RFP+GFP). 通过不同颜色斑点的计数可以清晰看出自噬流的强弱,实时监测自噬发生过程,准确,清晰,直观!
(自噬LC3双标腺病毒由汉恒生物独家提供)
研究的深入对自噬的检测方法也提出了更高的要求,自噬功能障碍包括自噬体形成和降解障碍。因此,准确全面地评估自噬不仅包括自噬体的检测,还包括动态观察整个自噬性降解的过程是否顺畅(即自噬潮分析)。
另外,通过药物或基因干预技术来人为地调控自噬以观察其在体内体外模型中的作用也是自噬分析的重要内容。需要注意的是,任何一种方法单独应用均不能作为自噬的依据。对任何方法得到的结果进行解释时必须慎重,特别是不能将自噬体的增多减少或自噬相关蛋白表达的高低等同于自噬的增强或减弱。