细胞自噬的研究方法介绍
嘉美纽诺生物
正常培养的细胞自噬活性很低,不适于观察,因此,必须对自噬进行人工干预和调节,经报道的工具药有:
一、自噬诱导剂
(1) Bredeldin A / Thapsigargin / Tunicamycin :模拟内质网应激
(2) Carbamazepine/ L-690,330/ Lithium Chloride(氯化锂):IMPase 抑制剂(即Inositol monophosphatase,肌醇单磷酸酶)
(3) Earle's平衡盐溶液:制造饥饿
(4) N-Acetyl-D-sphingosine(C2-ceramide):Class I PI3K Pathway抑制剂
(5) Rapamycin:mTOR抑制剂
(6) Xestospongin B/C:IP3R阻滞剂
二、自噬抑制剂
(1) 3-Methyladenine(3-MA):(Class III PI3K) hVps34 抑制剂
(2) Bafilomycin A1:质子泵抑制剂
(3) Hydroxychloroquine(羟氯喹):Lysosomal lumen alkalizer(溶酶体腔碱化剂)
除了选用上述工具药外,一般还需结合遗传学技术对自噬相关基因进行干预:包括反义 RNA 干扰技术(Knockdown)、突变株筛选、外源基因导入等。
三、自噬过程进行观察和检测
细胞经诱导或抑制后,需对自噬过程进行观察和检测,常用的策略和技术有:
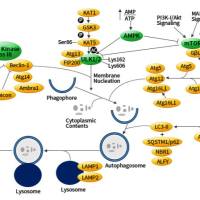
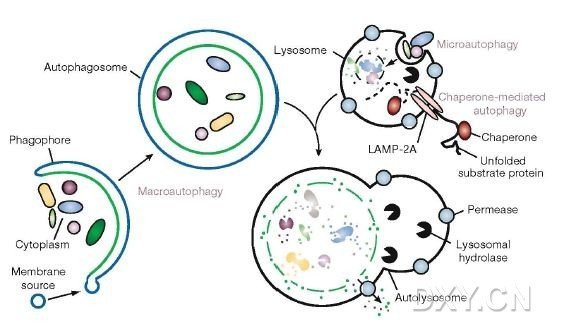
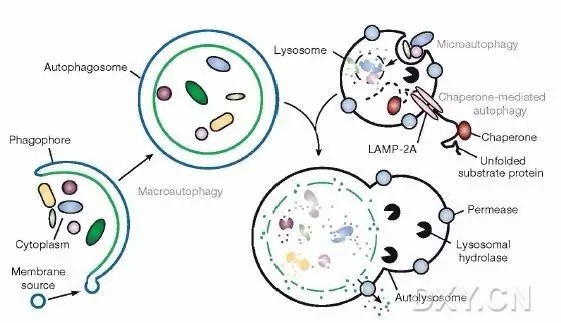
1、观察自噬体的形成
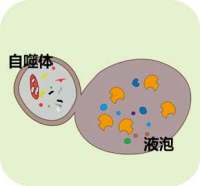
由于自噬体属于亚细胞结构,普通光镜下看不到,因此,直接观察自噬体需在透射电镜下。phagophore的特征为:新月状或杯状,双层或多层膜,有包绕胞浆成分的趋势。自噬体(AV1)的特征为:双层或多层膜的液泡状结构,内含胞浆成分,如线粒体、内质网、核糖体等。
自噬溶酶体(AV2)的特征为:单层膜,胞浆成分已降解。(autophagic vacuole,AV)
2、在荧光显微镜下采用 GFP-LC3 融合蛋白来示踪自噬形成
由于电镜耗时长,不利于监测(Monitoring)自噬形成,人们利用 LC3 在自噬形成过程中发生聚集的现象开发出了此技术。无自噬时,GFP-LC3 融合蛋白弥散在胞浆中;自噬形成时,GFP-LC3 融合蛋白转位至自噬体膜,在荧光显微镜下形成多个明亮的绿色荧光斑点,一个斑点相当于一个自噬体,可以通过计数来评价自噬活性的高低。
3、利用 Western Blot 检测 LC3-II/I 比值的变化以评价自噬形成
自噬形成时,胞浆型 LC3(即LC3-I)会酶解掉一小段多肽,转变为(自噬体)膜型(即LC3-II),因此,LC3-II/I 比值的大小可估计自噬水平的高低。
(注意:LC3 抗体对 LC3-II 有更高的亲和力,会造成假阳性。方法 2 和 3 需结合使用,同时需考虑溶酶体活性的影响。)
4、检测长寿蛋白的批量降解:非特异
5、MDC(Monodansylcadaverine,单丹磺酰尸胺)染色:包括自噬体,所有酸性液泡都被染色,故属于非特异性的。
6、CellTrackerTM Green染色:主要用于双染色,但其能染所有的液泡,故也属于非特异性的。
四、自噬相关蛋白的定位
(注意:这些蛋白均为胞浆蛋白,爬片或胰酶消化的细胞在做免疫荧光前需先透膜(permeablize),可采用 0.1%SDS 处理。)
实验案例 原代XXXX上皮细胞干预培养及MTT细胞增殖毒性检测
实验样本:原代XXXX上皮细胞
实验药物:A药物
刺激浓度:0.1%,0.01%,0.001%,0.000l%
时间点: 30 min、2 h、6 h、24 h
实验方案:常规细胞传代,用第 2~4 代细胞。传代后孵育至少 24 h 至细胞 70% 融合:细胞移入 96 孔板内,5×103 细胞/孔, 待细胞贴壁后,移去原培养液,加入含 0.1%,0.01%,0.001% ,0.000l% 共 4 个浓度的 A 药物培养液。
在 30 min、2 h、6 h、24 h 共 4 个时间点时实验终止,每孔加入 5 mg/mL 的 MTT 溶液 20uL,继续孵育 4 h,终止培养,小心吸弃孔内培养上清液,每孔加 DMSO(Dimethyl sulfoxide)150 uL,室温下振荡 10 min,立刻在酶联免疫监测仪上测定各孔吸光度值 (选择波长 490 nm)。
每浓度每时间点做 5 孔。设空白对照 1 孔 (不加细胞只加培养液), 最后比色以对照孔调零。实验试剂:MTT(sigma)
操作步骤:在 96 孔板加入细胞 100μL/孔(约 5×103),置 37℃ 5%CO2 细胞培养箱培养 24 小时;
待细胞贴壁后,移去原培养液,加入含 0.1%,0.01%,0.001% ,0.000 l% 共 4 个浓度 A 药物培养液;
在 30 min、2 h、6 h、24 h 共 4 个时间点时实验终止;每孔加入 5 mg/ml 的 MTT 溶液 20ul,继续孵育 4 h,终止培养,小心吸弃孔内培养上清液;每孔加 DMSO(Dimethyl sulfoxide)150 uL,室温下振荡 10 min,立刻在酶联免疫监测仪上测定各孔吸光度值 (选择波长 490 nm)。
实验分组:
A 正常培养组
B 0.0001% A 药物培养液
C 0.001% A 药物培养液
D 0.01% A 药物培养液
E 0.1% A 药物培养液
结果分析:细胞存活率% =(加药细胞 OD -本地 OD /对照细胞 OD-本地 OD)×100%
注:本底 OD 值(完全培养基加 MTT,无细胞)
30 min 时,490 nm 波长各孔的 OD 值
| 分组 | 样本1 | 样本2 | 样本3 | 样本4 | 样本5 | 平均值 | |
| A | 0.487 | 0.481 | 0.466 | 0.473 | 0.459 | 0.4732 | |
| B | 0.465 | 0.453 | 0.441 | 0.437 | 0.432 | 0.4456 | 94.1% |
| C | 0.421 | 0.416 | 0.414 | 0.408 | 0.435 | 0.4188 | 88.3% |
| D | 0.406 | 0.395 | 0.388 | 0.384 | 0.393 | 0.3932 | 82.8% |
| E | 0.388 | 0.373 | 0.369 | 0.377 | 0.382 | 0.3778 | 79.5% |
| 本底 | 0.007 | 0.009 | 0.012 | 0.008 | 0.008 | 0.0088 |
2h时,490 nm波长各孔的OD值
| 分组 | 样本1 | 样本2 | 样本3 | 样本4 | 样本5 | 平均值 | |
| A | 0.507 | 0.524 | 0.511 | 0.505 | 0.496 | 0.5086 | |
| B | 0.488 | 0.479 | 0.463 | 0.466 | 0.470 | 0.4732 | 92.9% |
| C | 0.453 | 0.449 | 0.466 | 0.451 | 0.447 | 0.4532 | 88.9% |
| D | 0.428 | 0.434 | 0.437 | 0.419 | 0.422 | 0.428 | 83.9% |
| E | 0.407 | 0.386 | 0.393 | 0.406 | 0.399 | 0.3982 | 78.0% |
| 本底 | 0.006 | 0.009 | 0.007 | 0.007 | 0.008 | 0.0074 |
6h时,490 nm波长各孔的OD值
| 分组 | 样本1 | 样本2 | 样本3 | 样本4 | 样本5 | 平均值 | |
| A | 0.569 | 0.570 | 0.562 | 0.557 | 0.568 | 0.5652 | |
| B | 0.547 | 0.552 | 0.541 | 0.536 | 0.544 | 0.544 | 96.2% |
| C | 0.523 | 0.515 | 0.511 | 0.508 | 0.512 | 0.5138 | 90.8% |
| D | 0.475 | 0.461 | 0.476 | 0.455 | 0.448 | 0.463 | 81.7% |
| E | 0.427 | 0.421 | 0.418 | 0.422 | 0.404 | 0.4184 | 73.7% |
| 本底 | 0.008 | 0.009 | 0.007 | 0.007 | 0.009 | 0.008 |
24h时,490 nm波长各孔的OD值
| 分组 | 样本1 | 样本2 | 样本3 | 样本4 | 样本5 | 平均值 | |
| A | 0.655 | 0.647 | 0.658 | 0.649 | 0.662 | 0.6542 | |
| B | 0.623 | 0.619 | 0.615 | 0.634 | 0.622 | 0.6226 | 95.1% |
| C | 0.604 | 0.575 | 0.591 | 0.587 | 0.582 | 0.5878 | 89.7% |
| D | 0.503 | 0.526 | 0.522 | 0.518 | 0.515 | 0.5168 | 78.7% |
| E | 0.437 | 0.448 | 0.421 | 0.446 | 0.438 | 0.438 | 66.5% |
| 本底 | 0.008 | 0.009 | 0.009 | 0.011 | 0.008 | 0.009 |

![十二烷基二甲基(3-磺丙基)氢氧化铵内盐 [用于生化研究],14933-08-5,≥98%,阿拉丁](https://img1.dxycdn.com/p/s14/2024/0619/475/6370229598169633081.jpg!wh200)