染色质免疫沉淀芯片(Chip-Chip)
互联网
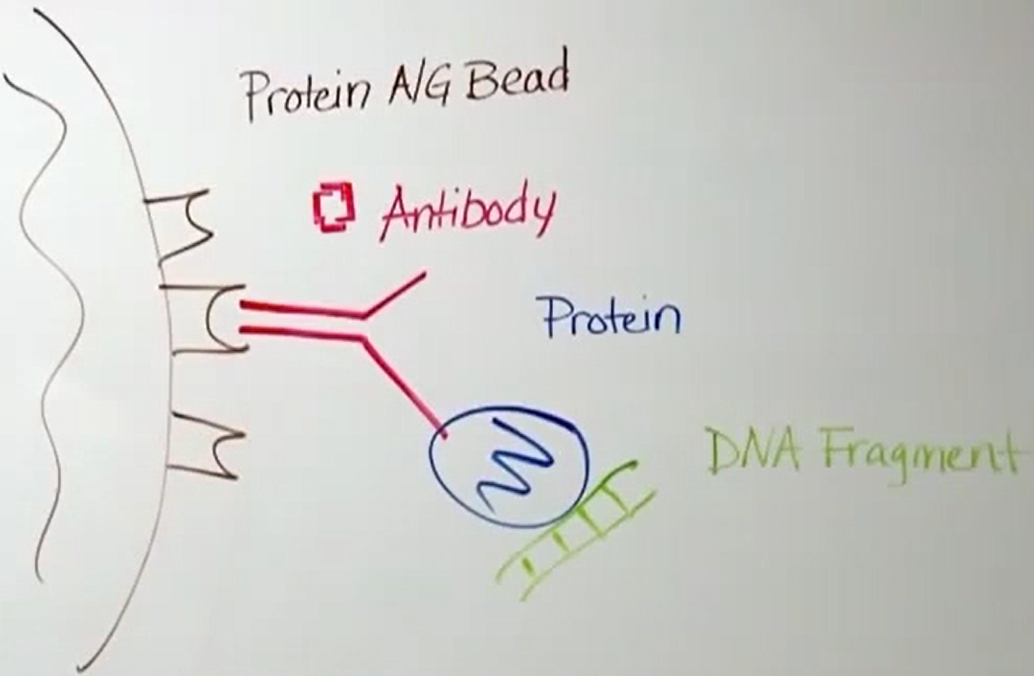
该技术能够快速在目标基因组的染色体中确定特异DNA结合蛋白的准确结合位点,ChIP芯片也可以在一个基因组的任何感兴趣的区域内寻找染色体的结构改变。
一、ChIP-Chip的用途
(1)在基因组范围内确定基因转录因子的DNA结合位点和其他DNA结合蛋白或蛋白复合体的DNA结合位点。
(2)染色体活性状态的定量分析。
(3)组蛋白修饰的功能研究。通过用酰基化或甲基化的组蛋白的特异抗体和没有进行修饰的组蛋白的特异抗体,可以确定与组蛋白修饰有关的结合模式的变化。
(4)聚合酶活性的定量分析。
(5)精炼生物信息方法,用功能数据来确定启动子的位置。
二、GeneChip-TilingArray技术简介
Affymetrix公司于2006年1月24日宣布推出GeneChip(R)人类和鼠源嵌合芯片(TilingA,ray)系列产品。该系列芯片研究范围大大超出已知编码蛋白序列,可以对整个人类和小鼠基因组进行系统的研究。研究人员可以利用这一芯片对转录因子和其他蛋白结合结构域进行研究。最近,更有研究人员利用Affymetrix的嵌合芯片在过去认为是垃圾DNA的区域中间找到了许多以前从未发现过的转录活性区域。
嵌合芯片(TilingArray)是迄今为止分辨率最高的基因芯片类型,其探针设计几乎涵盖了目标DNA的全部序列。迄今为止,Affymetrix公司已经开发出了人、小鼠、酵母、线虫、拟南芥等模式生物的全基因组Tiling芯片,为全基因组规模上研究目的蛋白与核酸的相互作用提供了强有力的分析工具。GeneChip-TilingArray除了全基因组芯片外,还包括了专门应用于ChIP—Chip技术中的人启动子和小鼠启动子两款芯片,探针设计覆盖了转录起始位点附近10kb的范围,可针对肿瘤相关的1 300个基因,覆盖范围更是增加到了12.5kb。
1882年,德国细胞学家弗莱明首次公开发表了细胞有丝分裂现象的观察结果,他的工作也被看作是科学史上最重要的发现之一。除了对有丝分裂进行描绘以及命名之外,弗莱明还对这一过程中看似起关键作用的物质——染色质作了标记。
目前,它是生物学两个最热门领域——基因组学和蛋白组学研究关注的焦点。但是,不同之处在于:弗莱明采用的是光学显微镜和装有少量苯胺染色的玻璃瓶对其进行研究,而最新的基因组阶段的染色质研究采用的是尖端的技术——染色质免疫沉淀作用测定法(ChIP)。
基因组学和蛋白组学都将把染色质作为研究对象,但两个领域采用的方法各异。在基因组学研究中,研究人员通常从一个蛋白质开始研究,采用ChIP去找出与基因组关联的蛋白质。而蛋白组学研究采用的是反向方法,先用一个特殊的DNA序列作为寻找蛋白质的诱饵;然后用ChIP去证实:那些蛋白质就是在体内与DNA序列相关联的蛋白质。
四、使用说明:
1. 样品超声处理条件的优化:
A. 准备适量冰浴预冷的PBS,以及100mM PMSF。将SDS Lysis Buffer适当温浴,使其中的SDS充分溶解,并混匀。
B. 将细胞培养于10cm细胞培养皿中,细胞培养液的用量为10 ml。在预期发生目的蛋白和基因组DNA结合的时间点,直接在细胞培养液中加入适量甲醛,轻轻混匀,至最终浓度为1%。随即在37℃孵育10分钟,以交联目的蛋白和相应的基因组DNA。例如,对于常规的每个10cm细胞培养皿中加入10 ml细胞培养液的情况,需加入270微升37%甲醛。请注意尽量使用高质量的在有效使用期限内的甲醛。细胞也可以培养于6cm细胞培养皿中,相关溶液的用量需按照比例进行相应调整。
C. 加入1.1ml Glycine Solution (10X),轻轻混匀。室温放置5分钟。
D. 将有细胞样品的培养皿置于冰浴上。吸尽含甲醛和glycine的培养液,尽量保持没有液体残留。
E. 在上述室温放置5分钟期间,用冰浴预冷的PBS稀释100mM PMSF至1mM,即配制成冰浴预冷的含1mM PMSF的PBS。PMSF水性溶液一定要新鲜配制,其在水相中的半衰期约为30分钟。
F. 加入5-10ml冰浴预冷的含1mM PMSF的PBS,洗涤细胞,吸尽液体,尽量保持没有液体残留。
G. 再加入5-10ml含冰浴预冷的1mM PMSF的PBS,进一步洗涤细胞,吸尽液体,尽量保持没有液体残留。
H. 加入1ml冰浴预冷的含1mM PMSF的PBS,用细胞刮子刮下细胞,收集至离心管中。如果细胞可以用枪吹打下来,也可以用枪吹打。对细胞进行计数,分装成每管大约100万细胞。
I. 4℃,800-1000g离心1-2分钟,以充分沉淀细胞。如果发现沉淀不充分,可以适当延长离心时间。吸尽上清,尽量减少液体残留。
J. 配制适量含有1mM PMSF的SDS Lysis Buffer。上一步骤的100万细胞沉淀用0.2ml含有1mM PMSF的SDS Lysis Buffer重悬。
K. 在冰浴上孵育10分钟,以充分裂解细胞。
L. 超声处理,以剪切基因组DNA,使DNA大部分断裂成200-1000bp大小,如果能把大部分控制在400-800bp则更佳。超声过程中请一定注意要保持样品处于冰浴中,并且处于较低温度。超声剪切的效果在后续去交联后可以用常规的DNA琼脂糖凝胶电泳检测。超声处理的条件通常可以设置为10秒每次,共3-4次,功率为50W时设置为最大功率的30%,采用2mm超声头。不同的超声处理仪器的设置不太一样,摸索超声条件时,可以先固定其他条件,先确定每次超声多长时间不会导致明显发热,然后摸索不同的超声次数。直至找到比较合适的超声次数可以使大部分基因组DNA断裂成200-1000bp大小。需要注意的是每次的超声体积和细胞用量宜固定,否则就不能使用一个相对比较固定的超声条件用于后续实验。
M. 在0.2ml经过超声处理的样品中加入8微升5M NaCl,混匀。65℃加热4小时,以去除蛋白和基因组DNA之间的交联。
N. 加入等体积的Tris平衡苯酚,vortex剧烈混匀,随后4℃,12000g左右离心5分钟。吸取上清至另一离心管中。
O. 加入等体积氯仿,vortex剧烈混匀,随后4℃,12000g左右离心5分钟。吸取上清至另一离心管中。
说明:上述步骤1N和1O的酚氯仿抽提可以使用DNA纯化试剂盒进行操作。例如碧云天的PCR/DNA纯化试剂盒(D0033)。
P. 取少量通过酚氯仿抽提或DNA纯化试剂盒获得的液体,对于酚氯仿抽提产物可以取5-10微升,对于DNA纯化试剂盒纯化产物可以取2-5微升,进行琼脂糖凝胶电泳,观察超声处理对于基因组DNA的剪切效果。
2. 染色质免疫沉淀:
A. 在对样品超声处理条件进行优化后,对于待检测样品按照步骤1A-1K进行操作,并参考步骤1L进行超声处理。
B. 随后对于经过超声处理的样品在4℃,12000-14000g离心5分钟。取上清(约0.2ml)至一2ml离心管中,置于冰浴。
C. 配制适量含有1mM PMSF的ChIP Dilution Buffer。加入1.8ml含有1mM PMSF的ChIP Dilution Buffer以稀释经过超声处理的样品,使最终体积为2毫升。
D. 取出20微升样品作为Input用于后续检测。其余近2ml样品加入70微升Protein A+G Agarose/Salmon Sperm DNA(其中约35微升为沉淀,35微升为液体),在4℃缓慢转动或摆动混匀30分钟。此步骤的目的是减少Protein A+G Agarose/Salmon Sperm DNA和目的蛋白或目的DNA序列的非特异性结合。
E. 4℃,1000g左右离心1分钟,将上清转移至一个新的2毫升离心管中。
F. 加入适量一抗,一抗的用量可以参考抗体的说明书。如果抗体的说明中未给出用于ChIP的稀释比例,可以参考普通的免疫沉淀的稀释比例。通常一抗的用量为0.5-1微克。4℃缓慢转动或摆动混匀过夜。可以不加抗体作为阴性对照,或用无关的抗体作为阴性对照,同时可以用没有细胞样品的溶液作为空白对照。
G. 加入60微升Protein A+G Agarose/Salmon Sperm DNA(其中约30微升为沉淀,30微升为液体),在4℃缓慢转动或摆动混匀60分钟,以沉淀一抗识别的蛋白或相应的复合物。
H. 4℃,1000g左右离心1分钟。非常小心地去除液体,切勿触及沉淀。随后依次用如下溶液对沉淀进行洗涤,每次洗涤液的用量为1ml,每次在4℃缓慢转动或摆动洗涤3-5分钟,随后4℃,1000g左右离心1分钟。非常小心地去除液体,切勿触及沉淀。
a. Low Salt Immune Complex Wash Buffer洗涤一次。
b. High Salt Immune Complex Wash Buffer洗涤一次。
c. LiCl Immune Complex Wash Buffer洗涤一次。
d. TE Buffer洗涤两次。
说明:完成上述所有洗涤步骤后所获得的沉淀即可用于PCR扩增目的基因序列或用Southern检测目的基因序列,或者用于Western检测等。
3. PCR扩增目的基因序列(如果ChIP产物用于检测目的基因序列):
A. 新鲜配制适量Elution buffer (1% SDS, 0.1M NaHCO3)。
B. 完成步骤2H后,即完成所有洗涤步骤后,加入250微升Elution buffer。Vortex混匀,室温转动或摆动继续洗脱3-5分钟。
C. 1000g左右离心1分钟,将上清转移到一新的离心管中。沉淀中再加入250微升Elution buffer。Vortex混匀,室温转动或摆动继续洗脱3-5分钟。
D. 1000g左右离心1分钟,取出上清。和上一步骤,即步骤3C中获得的上清合并。共计约500微升上清。
E. 在500微升上清中加入20微升5M NaCl,混匀。65℃加热4小时,以去除蛋白和基因组DNA之间的交联。对于步骤2D获得的作为Input的20微升样品,加入1微升5M NaCl,混匀,65℃加热4小时,同样用于去除蛋白和基因组DNA之间的交联。此步骤完成后可以继续进行后续步骤,也可以先-20℃冻存,第二天继续后续步骤。
说明:此时的样品已经可以用于PCR,可以尝试使用1、2、5或10微升样品作为模板用于PCR检测目的基因。此时PCR的效果和可能被沉淀下来的DNA的量,以及整个PCR扩增体系是否容易扩增目的基因有关。如果发现PCR效果欠佳,可以考虑通过后续的纯化步骤,纯化并浓缩样品,然后再进行PCR检测。
注意:通常情况下,推荐进行后续纯化后再进行PCR检测,而Input通常不必进行后续纯化步骤。
F. 在约520微升样品中加入10微升0.5M EDTA,20微升1M Tris pH 6.5和1微升20mg/ml 蛋白酶K。混匀后45℃孵育60分钟。
G. 加入等体积Tris平衡苯酚,vortex剧烈混匀,随后4℃,12000g左右离心5分钟。吸取上清至另一离心管中。
H. 加入等体积氯仿,vortex剧烈混匀,随后4℃,12000g左右离心5分钟。吸取上清至另一离心管中。
I. 加入20微克glycogen或yeast tRNA,加入1/10体积的3M NaAc,pH5.2,再加入2.5倍体积无水乙醇。混匀后-70℃沉淀不少于1小时,或-20℃沉淀8小时以上。
J. 4℃,12000-14000g离心10分钟,小心吸去大部分上清,切勿触及沉淀。
K. 加入约1ml 70%乙醇洗涤沉淀。4℃,12000-14000g离心10分钟,小心吸去大部分上清,切勿接触沉淀。
L. 4℃,12000-14000g离心1分钟,非常小心地吸除残留液体。
M. 用少量TE或水重悬DNA沉淀,用于目的基因的PCR检测。用于PCR的引物最好能设计2组,可以用Input作为模板预先摸索出相应的PCR条件,并选择一组效果较好的引物用于最终的PCR检测。少数情况下,当PCR条带过弱时,可以采用nested PCR技术,进行两轮扩增。
说明:步骤G至步骤M也可以采用适当的DNA纯化试剂盒纯化DNA,例如碧云天的PCR/DNA纯化试剂盒(D0033)。
4. Western检测ChIP产物(如果ChIP产物用于Western检测):
A. 接步骤2H,在完成所有的洗涤步骤后,加入25微升SDS-PAGE蛋白上样缓冲液(1X)。SDS-PAGE蛋白上样缓冲液(1X)可以用SDS-PAGE蛋白上样缓冲液(5X)用水稀释配制而成。沸水浴煮沸10分钟。
B. 可以取10-20微升用于Western检测