合作专家 | 陈慕华博士
肿瘤学 北京大学
审核专家 | 陈燚博士
肿瘤药理 中国科学院上海药物研究所
简介
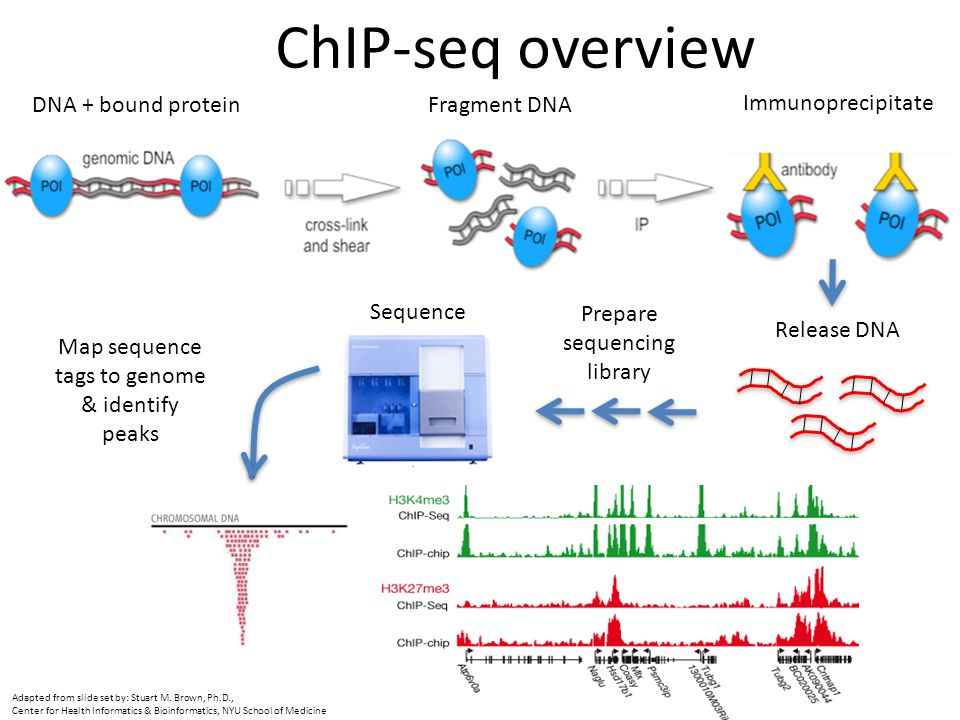
染色质免疫沉淀技术(Chromatin immunoprecipitation assay, ChIP)是目前唯一研究体内 DNA 与蛋白质相互作用的方法,主要包括 ChIP-qPCR 和 ChIP-seq 两种。利用 ChIP-seq 技术能够高效地在全基因组范围内检测与组蛋白修饰、转录因子等互作的 DNA 区段。
原理
真核生物的基因组 DNA 以染色质的形式存在。使用甲醛将目的蛋白和 DNA 交联固定,并通过超声处理或核酸酶消化使染色质碎裂;再利用抗体特异性沉淀分离组蛋白或转录因子等及其结合的染色质,即染色质免疫共沉淀产物;通过蛋白酶解交联,使目的蛋白与 DNA 分开,纯化 DNA 后通过下一代测序 (NGS) 技术检测和定量富集的 DNA 片段。
用途
用于分析与目的蛋白(转录因子或组蛋白)相互作用的 DNA 片段。
材料与仪器
甲醛、甘氨酸、预冷的 PBS、ChIP 裂解缓冲液、洗脱缓冲液、氯化钠、RNase、蛋白酶 K、Tris-EDTA (TE)、100 bp DNA marker、 1.5% 琼脂糖凝胶、RIPA 缓冲液、一抗、Protein A/G 磁珠、低盐洗涤缓冲液、高盐洗涤缓冲液、氯化锂洗涤缓冲液。
步骤
1.DNA-蛋白质交联和收集细胞
用甲醛交联蛋白质和 DNA。交联程序与时间有关,需要优化。
提示:样本的建议交联时间为 2~30 分钟,过度交联会降低抗原的可及性及超声效果,表位也可能被掩盖。加入甘氨酸封闭甲醛,终止交联反应。
1.1 首先,准备 2×107~1×108 个细胞。直接向培养基中逐滴滴加甲醛,至终浓度为 0.75%,然后在室温下轻柔旋转 10 分钟,促使蛋白质与 DNA 交联。
1.2 向培养基中添加甘氨酸,至终浓度为 125 mM,室温下振荡孵育 5 分钟。
1.3 用 10 mL 冰的 PBS 冲洗细胞 2 次。
1.4 加入 5 mL 冰的 PBS,刮下细胞,移入离心管中。
1.5 4 ℃,1 000 g 离心 5 分钟。
1.6 小心吸取上清液,将沉淀重悬于 ChIP 裂解缓冲液中(每 107 个细胞加 750 μL),置于冰上孵育 10 分钟。
2. 对细胞裂解液进行超声处理,以分离染色质
2.1 对裂解液进行超声处理以剪切 DNA,并确保 DNA 的平均片段大小为 200~1 000 bp。超声处理时间需要优化。
2.2 超声处理完成后,4 ℃,8 000 g 离心 10 分钟,取上清液至新管中。
3. 计算 DNA 浓度,并测定 DNA 片段大小
经过超声处理的染色质样本可用于计算后续 IP 的 DNA 浓度,并电泳检测 DNA 片段大小。
3.1 取 50 μL 经超声处理的样本,测定 DNA 浓度和片段大小。
3.2 向 50 µL 染色质中加入 70 µL 洗脱缓冲液。
3.3 加入 4.8 µL 5 M NaCl 和 2 µL RNase A(10 mg/mL),65 ℃ 下振摇孵育过夜。
3.4 加入 2 µL 蛋白酶 K(20 mg/mL),60 ℃ 下振摇孵育 1 小时。
3.5 使用 PCR 纯化试剂盒或苯酚:氯仿萃取法纯化 DNA。
3.6 为测定 DNA 浓度,取 5 μL 纯化 DNA,转移至含 995 μL TE 的试管中,稀释 200 倍,并读取 OD260。DNA 浓度 (μg/mL) 为 OD260×10 000。用于计算制备染色质的 DNA 浓度。在带 100 bp DNA marker 的 1.5% 琼脂糖凝胶中电泳纯化 DNA,以测定片段大小。
4. 染色质免疫沉淀(IP)
4.1 使用步骤 2.2 制备的染色质。建议每次 IP 使用约 25 μg DNA。按 1:10 的比例用 RIPA 缓冲液稀释每个样本。设置一个 IgG 抗体对照和一个仅加磁珠的对照。取 50 µL 染色质作为 input 样本,-20 ℃ 下保存备用。
4.2 在所有样本(仅加磁珠的对照除外)中加入一抗,并在 4 度下旋转孵育 1 小时。抗体用量应事先通过实验确定;一般来说,每 25 μg DNA 加入 1~10 μg 抗体(最佳抗体是经 ChIP 验证的抗体,IP 验证次之,抗体量参考厂家推荐)。
4.3 制备蛋白 A/G 磁珠(按照实验选择适合磁珠)
4.4 在所有样本中加入 60 µL 蛋白 A/G 磁珠,4 ℃ 下旋转过夜。
4.5 2 000 g 离心 1 分钟,除去上清液。
4.6 按照以下步骤进行洗涤:分别在低盐洗涤缓冲液、高盐洗涤缓冲液和氯化锂洗涤缓冲液中洗涤一次。每次洗涤后,2 000 g 离心 1 分钟,除去上清液。
5. 洗脱并解交联
5.1 在蛋白 A/G 磁珠中加入 120 μL 洗脱缓冲液,以洗脱 DNA,30 ℃ 下缓慢涡旋 15 分钟。
5.2 2000 g 离心 1 分钟,并将上清液转移至新管中。
5.3 加入 4.8 µL 5 M NaCl 和 2 µL RNase A(10 mg/mL),65 ℃ 下振摇孵育过夜。
5.4 加入 2 µL 蛋白酶 K(20 mg/mL),60 ℃ 下振摇孵育 1 小时。
5.5 DNA 可使用 PCR 纯化试剂盒或苯酚-氯仿萃取法进行纯化。
6. ChIP-seq 分析 DNA 水平
使用 ChIP-seq 方法时,通过测序进行 DNA 水平分析。使用该方案产生的 DNA 适合用作制备测序文库的 input。
注意事项
1. 蛋白 A 和 G 磁珠对各种属不同免疫球蛋白同种型的亲和力不同,根据使用的 IP 抗体选用。
2. 如果观察到高背景,可能需要增加洗涤步骤。也可以在步骤 4.2 之前,预先用蛋白 A/G 磁珠孵育 1 小时,去除与磁珠发生的非特异性结合。将上清液(经过超声处理的染色质)转移至一个新管中,然后按照步骤 4.2 对抗体和磁珠进行孵育。
常见问题
1. 为什么使用RNase A?
使用 PCR 纯化试剂盒时,高水平的 RNA 会干扰 DNA 纯化,因此需要使用 RNase A 处理样本。否则纯化柱吸附饱和时产物会大大减少。
2. 为什么使用蛋白酶 K?
用蛋白酶 K 处理样本,可使邻近脂肪与芳香族氨基酸羧基的肽键断裂。从而破坏蛋白质和 DNA 之间的交联,促进 DNA 的纯化。
3. 染色质消化片段过大(>1 000 bp)或过小(<150 bp)。
过度交联。交联超过 10 分钟可能会抑制染色质的消化。
添加至染色质消化的细胞不足。
不同细胞系所需的超声处理时间不同。
4. 阴性对照 IgG-IP 和实验组抗体 IP PCR 反应中产物的数量相等。
添加至 IP 反应的染色质过多或不足。或者,添加至 IP 反应的抗体过多。
5. 实验组抗体 IP PCR 反应中无产物。
添加至 PCR 反应的 DNA 不足。
添加至 IP 反应的抗体不足。
抗体不适用于 IP。
来源:丁香实验