RFLP和RAPD技术
互联网
第一节 概 述
DNA分子水平上的多态性检测技术是进行基因组研究的基础。RFLP(Restriction Fragment Length Polymorphism,限制片段长度多态性)已被广泛用于基因组遗传图谱构建、基因定位以及生物进化和分类的研究。RFLP是根据不同品种(个体)基因组的限制性内切酶的酶切位点碱基发生突变,或酶切位点之间发生了碱基的插入、缺失,导致酶切片段大小发生了变化,这种变化可以通过特定探针杂交进行检测,从而可比较不同品种(个体)的DNA水平的差异(即多态性),多个探针的比较可以确立生物的进化和分类关系。
所用的探针为来源于同种或不同种基因组DNA的克隆,位于染色体的不同位点,从而可以作为一种分子标记(Mark),构建分子图谱。当某个性状(基因)与某个(些)分子标记协同分离时,表明这个性状(基因)与分子标记连锁。分子标记与性状之间交换值的大小,即表示目标基因与分子标记之间的距离,从而可将基因定位于分子图谱上。分子标记克隆在质粒上,可以繁殖及保存。
不同限制性内切酶切割基因组DNA后,所切的片段类型不一样,因此,限制性内切酶与分子标记组成不同组合进行研究。常用的限制性内切酶一般是HindⅢ,BamHⅠ,EcoRⅠ,EcoRV,XbaⅠ,而分子标记则有几个甚至上千个。分子标记越多,则所构建的图谱就越饱和。构建饱和图谱是RFLP研究的主要目标之一。
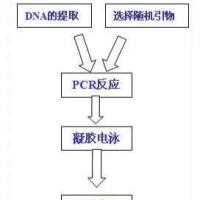
运用随机引物扩增寻找多态性DNA片段可作为分子标记。这种方法即为RAPD(Random amplified polymorphic DNA ,随机扩增的多态性DNA)。尽管RAPD技术诞生的时间很短, 但由于其独特的检测DNA多态性的方式以及快速、简便的特点,使这个技术已渗透于基因组研究的各个方面。
该RAPD技术建立于PCR技术基础上,它是利用一系列(通常数百个)不同的随机排列碱基顺序的寡聚核苷酸单链(通常为10聚体)为引物,对所研究基因组DNA进行PCR扩增.聚丙烯酰胺或琼脂糖电泳分离,经EB染色或放射性自显影来检测扩增产物DNA片段的多态性,这些扩增产物DNA片段的多态性反映了基因组相应区域的DNA多态性。
RAPD所用的一系列引物DNA序列各不相同,但对于任一特异的引物,它同基因组DNA序列有其特异的结合位点.这些特异的结合位点在基因组某些区域内的分布如符合PCR扩增反应的条件,即引物在模板的两条链上有互补位置,且引物3'端相距在一定的长度范围之内,就可扩增出DNA片段.因此如果基因组在这些区域发生DNA片段插入、缺失或碱基突变就可能导致这些特定结合位点分布发生相应的变化,而使PCR产物增加、缺少或发生分子量的改变。
通过对PCR产物检测即可检出基因组DNA的多态性。分析时可用的引物数很大,虽然对每一个引物而言其检测基因组DNA多态性的区域是有限的,但是利用一系列引物则可以使检测区域几乎覆盖整个基因组。因此RAPD可以对整个基因组DNA进行多态性检测。另外,RAPD片段克隆后可作为RFLP的分子标记进行作图分析。
本实验将学习RFLP的酶切,电泳和膜的制作以及RAPD技术。探针标记及杂交检测方法请另详见分子杂交技术。
第二节 RFLP技术
RAPD技术在水产科研中的应用
一、 材料
基因组DNA(大于50kb,分别来自不同的材料)。
二、设备
电泳仪及电泳槽, 照相用塑料盆5只,玻璃或塑料板(比胶块略大) 4块,吸水纸若干,尼龙膜(依胶大小而定),滤纸 ,eppendorf管(0.5ml)若干。
三、试剂:
1、限制性内切酶(BamHⅠ, EcoRⅠ, HindⅢ, XbaⅠ)及10×酶切缓冲液。
2、5×TBE电泳缓冲液:配方见第一章。
3、变性液:0.5mol/L NaOH,1.5mol/L NaCl 。
4、中和液:1mol/LTris·Cl, pH7.5/1.5mol/L NaCl 。
5、10×SSC:配方见第九章。
6、其它试剂:0.4mol/L NaOH,0.2mol/L Tris·Cl, pH7.5/2×SSC ,ddH2O,Agarose 0.8%, 0.25mol/L HCl 。
1. 基因组DNA的酶解
(1) 大片断DNA的提取详见基因组DNA提取实验,要求提取的DNA分子量大于50kb, 没有降解。
(2) 在50μl反应体系中,进行酶切反应:
5μg基因组DNA
5μl 10×酶切缓冲液
20单位(U)限制酶(任意一种)
加ddH2 O, 至50μl
(3) 轻微振荡, 离心,37℃反应过夜。
(4) 取5μl反应液,0.8%琼脂糖电泳观察酶切是否彻底,这时不应有大于30kb的明显亮带出现。
[注意] 未酶切的DNA要防止发生降解, 酶切反应一定要彻底。
2. Southern转移
(1) 酶解的DNA经0.8%琼脂糖凝胶电泳(可18V过夜)后EB染色观察。
(2) 将凝胶块浸没于0.25mol/L HCl中脱嘌呤, 10分钟。
(3) 取出胶块, 蒸馏水漂洗, 转至变性液变性45分钟。经蒸馏水漂洗后转至中和液中和30分钟。
(4) 预先将尼龙膜,滤纸浸入水中,再浸入10×SSC中,将一玻璃板架于盆中铺一层滤纸(桥)然后将胶块反转放置,盖上尼龙膜,上覆二层滤纸,再加盖吸水纸,压上半公斤重物, 以10×SSC盐溶液吸印,维持18-24小时。也可用电转移或真空转移。
(5) 取下尼龙膜, 0.4mol/L NaOH 30秒, 迅速转至0.2mol/L Tris·Cl,pH7.5/2×SSC,溶液中, 5分钟。
(6) 将膜夹于2层滤纸内, 80℃真空干燥2小时。
(7) 探针的制备和杂交见第九章分子杂交部分。
[注意] 1、 步骤(2)中脱嘌呤时间不能过长。
2、 除步骤(1)、(4)、(5)外, 其余均在摇床上进行操作。
3、步骤(4)中,当尼龙膜覆于胶上时, 绝对防止胶与膜之间有气泡发生, 加盖滤时也不应有气泡发生。
4、有时用一种限制性内切酶不能发现RFLP的差异,这时应该试用另一种酶。
第三节 RAPD技术
一、 材料
不同来源的DNA(50ng/ul)。
二、设备
PCR仪,PCR管或硅化的0.5ml eppendorf管,电泳装置。
三、试剂
1、随机引物(10mer) (5umol/L):购买成品。
2、Taq酶:购买成品。
3、10xPCR 缓冲液:配方见第八章。
4、MgCl2 :25mmol/L。
5、dNTP:每种2.5mmol/L。
四、操作步骤:
1. 在25ul反应体系中,加入
模板DNA 1ul (50ng)
随机引物 1ul (约5pmol)
10xPCR Buffer 2.5ul
MgCl2 2ul
dNTP 2ul
Taq酶 1单位(U)
加ddH2O 至 25ul
混匀稍离心, 加一滴矿物油。
2. 在加热至90℃以上的PCR仪中预变性94℃ 2分钟, 然后循环: 94℃ 1分钟, 36℃ 1分钟, 72℃ 1分钟,共40轮循环。
3. 循环结束后, 72℃ 10分钟,4℃保存。
4. 取PCR产物15ul加3ul上样缓冲液(6x)于2% 琼脂糖胶上电泳, 稳压50-100V(电压低带型整齐, 分辨率高)。
5. 电泳结束,观察、拍照。
[注意] 1、电泳时一般RAPD带有5-15条, 大小0.1-2.0kb。
2、 特异性的DNA带可以克隆作为一个新的分子标记应用。
思考题
1. DNA酶切反应不彻底会有何结果? DNA发生降解有何影响?
2. Southern转移中脱嘌呤时间为何不能太长?
3. 随机引物扩增,为什么会产生DNA双链产物?
RAPD技术,即随机扩增多态DNA(Random Amplified Polymorphic DNA)技术,是由美国科学家J.Williams和J.Welsh两个研究小组在聚合酶链式反应(Polyinerase Chain Reaction,PCR)技术的基础上发展起来的,它是一种用于检测基因组DNA多态性和基因组遗传标记的方法。目前已被广泛应用于系统发育研究、动植物种类鉴定、基因图谱构建、种群的遗传分析、人类基因组研究等领域。
1 RAPD技术的原理
RAPD技术是建立在PCR技术的基础上,它用一系列(通常数百个)不同的随机排列碱基序列的寡核苷酸单链(一般为10个bp)作为引物,对所研究的基因组DNA进行单引物扩增。模板DNA经90—94变性解链后在较低温度(36~37℃)下退火,这时形成的单链模板会有许多位点与引物互补配对,在72℃下,通过链延伸,形成双链结构,完成DNA合成。重复上述过程,即可产生片段大小不等的扩增产物,通过电泳分离和显色便可得到许多不同的条带,从中筛选出特征性条带。扩增产物片段的多态性反映了基因组DNA的多态性。如果基因组在这些区域内发生DNA片段插入、缺失或碱基突变就可能导致这些特定结合位点的分布发生相应的变化,而使PCR产物增加、缺少或发生分子量的改变。因此,通过对PCR产物的检测即可测出基因组DNA在这些区域的多态性。进行RAPD分析时,可用引物的数量很大,虽然对每个引物而言,其检测基因组DNA多态性的区域是有限的,但是利用一系列引物则可以使检测区域几乎覆盖整个基因组。因此,RAPD可以对整个基因组DNA进行多态性检测。
RAPD技术的优点:①不使用同位素,减少了对工作人员健康的危害;②可以在物种没有任何分子生物学研究的情况下分析其DNA多态性;③对模板DNA的纯度要求不高;④技术简单,无需克隆DNA探针,无需进行分子杂交;⑤灵敏度高,可提供丰富的多态性;⑥RAPD引物没有严格的种属界限,同一套引物可以应用于任何一种生物的研究,因而具有广泛性、通用性。
但是,RAPD技术较易受到各种因素的影响。无论是模板的质量和浓度,短的引物序列,PCR的循环次数,基因组DNA的复杂性,技术设备等,都有可能是RAPD技术重复性差的直接原因。目前,多从以下几个方面来提高反应的稳定性:①操作规范,反应体系的组成要力求一致,尽可能地使RAPD反应标准化;②提高扩增片段的分辨率;③将RAPD标记转化为SCAR标记后再进行常规的PCR分析,可以提高反应的稳定性及可靠性。
2 RAPD技术在鱼类、虾蟹类研究中的应用
2.1在遗传资源研究中的应用
目前,海产虾、蟹类遗传变异的检测大多通过检测同工酶的变异来进行,所揭示的同工酶的多态性相对较低。RAPD分析中所需的样品量极少,其操作程序简单易行,实验周期短,因而可以对数量较多的样品进行分析。利用一套引物可得到不同种属、品系、群体甚至是个体的大量的RAPD分子标记,并可借助于计算机进行系统分析,RAPD技术的这些特点使得它可以在虾、蟹类群体遗传学、遗传多样性分析中发挥重要作用。
RAPD标记可以用来进行虾、蟹类群体遗传学研究,检测种群内、种群间的遗传多样性水平,并为种群识别提供可靠的遗传标记。Garcia等尝试在斑节对虾中利用RAPD分析不同地理群体间的遗传多样性,并就其在虾类选育中的应用作了初步探讨。Garcia以及A1civar—Warren等在高健康(High Health Shrimp)和无特异病原(Specific—Pathogen—Free,SPF)的南美白对虾培育中,用RAPD技术对野生种群以及不同的家系进行监测和分析,发现其多态位点的比例为50%左右,其中一个家系的多态位点比例高达77%。刘萍等用RAPD技术对中国对虾黄渤海沿岸种群亲本及子一代的基因组DNA多态性进行了研究,结果证实子代之间的遗传距离比其父母与子代之间更小,遗传变异程度更低。邱高峰等用RAPD技术分析了我国近海烟台、长岛等4个地方的20只中国对虾的种群内和种群间遗传差异,结果表明不同地理种群之间存在一定程度的遗传差异。石拓等,刘萍等、刘振辉等对中国对虾不同地理种群的遗传多样性进行了RAPD分析,结果表明,中国对虾的遗传多样性水平较低。高志干等对中华绒螯蟹的辽河和长江种群进行RAPD分析,结果显示,其种内遗传变异较低,3个种群中,辽河种群和颐江种群遗传变异较高,而长江种群遗传变异较低;辽河种群间遗传距离小于它们与种群间的遗传距离。甘西等利用RAPD技术对罗氏沼虾的NY群体和NX群体的遗传多样性进行了研究,NY群体的变异明显小于NX群体。宋林生等及庄志猛等用RAPD技术研究了日本对虾野生种群和养殖种群的遗传结构,结果表明,野生种群多态性位点的比例和杂合度明显高于养殖群体,说明中国沿海的日本对虾野生种群的种质资源状况较好,应加以保护。
一个较为详细的遗传连锁图谱不仅对该物种的遗传学基础研究有重要意义,同时对该物种的育种研究也很有帮助。Potlethwait和Stephen等用RAPD技术进行斑马鱼遗传连锁图谱的制作。Liu把RAPD技术应用到鲶鱼基因图谱研究中。孙效文等建立了鲤鱼的遗传连锁图谱。图谱有RAPD分子标记56个,鲤鱼的SSLP标记26个,鲫鱼的SSLP标记有19个,斑马鱼的SSLP标记有70个,鲤鱼基因标记91个,图谱有50个连锁组,连锁图给出鲤鱼的基因组大小在5789cm左右。
2.2确定种、品种间的亲缘关系
种群亲缘关系的传统研究方法是从形态学、细胞学、生化指标等方面进行,但受个体和环境的影响较大,有时不能反映物种本身所固有的特征。物种基因组的组成在RAPD图谱上得到体现,亲缘关系越近,基因组中的同缘序列越多,则以相同引物扩增出的共有标记也就越多。因此,RAPD技术与传统方法结合是研究物种亲缘关系的有效手段。对不同种、同种不同群体的DNA进行RAPD分析,筛选出特征性条带,计算相似系数和遗传距离,从而可确定它们的亲缘关系。李思发等用RAPD技术研究中国沿海六水系绒螯蟹(中华绒螯蟹和日本绒螯蟹)群体的亲缘关系,从48个引物中筛选出2个具有群体特异性的引物,其中Z2扩增的880bp片段为珠江蟹和南流江蟹两群体所共有,扩增的700bP片段为长江蟹、黄河蟹、辽河蟹、瓯江蟹四群体所特有。这可作为区别中华绒螯蟹(长江蟹、黄河蟹、辽河蟹、瓯江蟹)和日本绒螯蟹(珠江蟹、南流江蟹)的分子遗传标记。用RAPD技术对中国沿海六水系绒螯蟹进行两大类型划分与生化遗传差异分析、形态特征多元分析的结果一致。宋林生等用RAPD方法研究对虾属六个种间的亲缘关系,用20个随机引物扩增,共得到364条清晰稳定的多态性片段,根据扩增片段的共享度计算相对遗传距离指数,然后用UPGMA和NJ等聚类方法对其进行分析,构建系统树,确定了它们之间的亲缘关系。聚类分析的结果为:中国对虾、长毛对虾和墨吉对虾三者的关系最近,它们首先聚类在一起,然后与斑节对虾聚在一起,最后是南美白对虾和日本对虾。从其结果可以看出,外部形态比较相似的种类在基因组DNA上表现出较大的相似性,反之则较小。宋林生等用RAPD方法研究六种海产虾类基因组DNA多态性,结果显示六种虾的亲缘关系与传统的分类结果基本一致。谢浩等用RAPD方法研究三种绒螯蟹的亲缘关系,用一组引物对每种各10个个体的基因组DNA进行扩增,得到一批特异、可重复的扩增图谱。扩增区带相似串的分析结果表明,中华绒螯蟹与日本绒螯蟹的亲缘关系较远,而南流江的绒螯蟹(合浦亚种)与日本绒螯蟹较近。
Borrwsky等用随机引物扩增产物重新构建了脊椎动物DNA指纹图。Sultman等用DNA标记对丽鱼科鱼类的系统发育进行了研究。何舜平等运用RAPD的方法对五种鲤科鱼类进行了分析,并论述了鮈鲫的系统位置。何舜平等通过对鲤科鱼类的随机扩增,获得了大量有系统发育信息的DNA多态片段,并绘制了低等鲤科鱼类代表属种的分支系统图。夏德全等用RAPD方法分析太湖大银鱼、太湖新银鱼和寡齿新银鱼的亲缘关系,同时发现有个别样品的核基因组与太湖中已有的几种银鱼有显著差异。邹曙明等用RAPD方法研究草鱼、柏氏鲤和3个地理种群鲤的亲缘关系,研究结果支持中国东部鱼类具有双重来源性的观点。
2.3特定基因的标记
利用DNA分子水平上的变异作为遗传标记进行基因标记已成为可能。周开亚等用RAPD方法研究鉴别中华绒螯蟹种群,用200个随机引物对中华绒螯蟹辽河种群、长江种群和瓯江种群进行RAPD分析,其中引物HX01和HX02检测到瓯江种群和辽河种群所有样品共有HX01—0.4和HX02—0.7扩增片段;而长江种群样品的PCR反应中无这两个扩增片段出现,因而可作为长江种群的鉴别标记。未发现可区分瓯江种群和辽河种群的标记。谢浩等用RAPD方法研究三种绒螯蟹的亲缘关系,用引物OPO—05对25个中华绒螯蟹个体、27个日本绒螯蟹个体及12个日本绒螯蟹合浦亚种个体扩增,发现中华绒螯蟹所有个体都能扩增出一条大小约为1kb的区带,且相当明显和稳定,而其它两种在相同条件下仅有个别个体能扩增出相当微弱的区带。因此,可将这一区带作为一个遗传标记,用于鉴别中华绒螯蟹与日本绒螯蟹及其合浦亚种。
目前RAPD已广泛应用于鉴别、鉴定不同的生物种类。Johnson用RAPD技术鉴定了不同实验室品系的斑马鱼。薛国雄对长江、珠江、黑龙江三大水系的草鱼产卵场及太湖中捕捞的草鱼进行覆盖性的RAPD分析,结果表明每一水系的草鱼种群均有其特征性基因图谱,可作为种群鉴定的依据。夏德全等应用该技术检测了一个奥利亚罗非鱼养殖群体和湘湖,美国和沙市三个尼罗罗非鱼养殖群体,获得了鉴别尼罗罗非鱼和奥利亚罗非鱼的分子遗传标记。姚纪花等利用20个随机引物对产于方正、彭泽和淇河地区的三个银鲫种群进行了RAPD检测,也获得了银鲫种群鉴定的分子标记。邓怀等对青鱼、草鱼、鲢鱼、鳙鱼、鲫鱼、鲤鱼、团头鲂、胭脂鱼、土鲶和黄颡鱼进行了RAPD—PCR扩增。结果显示RAPD是一种非常灵敏的种间鉴定技术,特别是对鱼卵和鱼苗的鉴定有重要意义。郑光明等以池养的鲮、麦鲮为材料,提取血液基因组DNA,利用随机引物进行PCR扩增,通过缩短扩增时间和电泳时间,快速鉴定了三种不同的鲮鱼,并建立了一套DNA分子水平上的快速鉴定鱼种的方法。
2.4识别同一物种的性别差异
虾、蟹的性染色体没有统一的模式,用常规核型分析方法不能鉴别性染色体。通过RAPD技术可找出同一物种不同性别的基因组DNA特征性条带,从而有助于研究性别控制机制,也可为性别确定提供分子依据。邱涛用RAPD技术识别中华绒螯蟹的性别,200个引物中有17个引物扩增出群体水平的差异,其中一个引物(OPM14)扩增出个体水平的差异:雄性有一个800bP的特异带,而雌性没有。这可作为有价值的性别鉴别标记。
2.5监测遗传渗入,维持物种遗传多样性
目前,人为的养殖活动、人工放流等使得虾、蟹类种内不同种群间非自然的遗传渗入已相当普遍,应引起重视,需加以监测并收集数据,为保护种质资源、维持物种遗传多样性提供依据。李思发等用RAPD指纹标记研究中国大陆六水系绒整蟹的亲缘关系,引物OPP17扩增的947bP片段的出现频率,在长江、黄河、辽河三群体中显著地从南到北递减,长江蟹87.5%、黄河蟹41.66%、辽河蟹10.83%。这一遗传渗入的度量可作为区别三水系中华绒螯蟹的判据。邱涛等用RAPD方法研究中华绒螯蟹长江、辽河、瓯江水系三群体的遗传多样性,并未发现三群体间存在特征性条带,但群体间差异大于群体内差异。未发现群体间的分子遗传标记,但三群体间确实存在差异,表明近来种质资源混杂,遗传渗入是其中原因之一。
RAPD标记可用于群体遗传学研究,检测种群内、种群间的遗传多样性水平,并为种群识别提供可靠的遗传标记。Bardakci等用RAPD技术评估了罗非鱼的种群内、种群间的遗传变异度。Bielawski等进行了太平洋海岸条斑鲈的RAPD分析。Caccone等对欧洲尖吻鲈的DNA多态性进行RAPD—PCR分析。Garcia等尝试在斑节对虾中用RAPD分析不同地理群体间的遗传多态性,并就其在虾类选育中的应用作了初步探讨。王绕梅等用RAPD技术检测野生鲫鱼和四个金鱼代表种的基因组DNA多态性。张德春用该技术对湖北、广西两个鲢鱼人工养殖群体进行了遗传多样性的比较研究,为链鱼人工繁殖的科学规范提供一定的理论依据。张四明等进行了中华鲟随机扩增多态性DNA及遗传多样性研究,结果显示中华鲟天然群体核DNA水平的遗传多样性较低,从而为中华鲟资源的监测和保护提供了理论依据。石拓等用该技术对中国对虾朝鲜半岛西海岸群体的基因组DNA多态性进行了检测,表明该对虾群体的遗传多样性水平较低。宋林生等对日本对虾野生群体和养殖群体的遗传结构的RAPD标记进行了初步的研究,并认为将RAPD以及其他分子标记技术用于海洋动物的育苗育种中,进行标记辅助育种,是海洋动物增养殖健康发展的有力保证。
RAPD技术程序简单快捷,且无需事先确定目的基因的序列,无种属特异性,有无数的引物可供利用,能产生足够的多态性,无需同位索,可以鉴别物种之间和种群之间的基因组的差异,也可区分个体之间的差异。为此,许多从事水产育种工作的科研人员已把RAPD技术应用到水产遗传育种上,并已取得—定的成果。在海水鱼类(如大黄鱼等)、海水虾类的种质资源研究中,由于同工酶所揭示的种内水平上的遗传差异水平非常低,而RAPD比同工酶更能指示DNA多态性,因此RAPD分子标记在鱼类、虾类、蟹类种质资源遗传学研究中有着广泛的应用前景。目前RAPD分析主要应用于标记鉴定、遗传作图、系统发育和进化及亲缘关系的研究、种群的划分、群体遗传多样性研究等。但在实际应用中,RAPD也表现出不足,如显阳性位点,在后代中不能区别是纯合体还是杂合体;稳定性较差;高度的变异性等缺点。当然有些是可以避免的,解决的方法是对单链引物进行筛选,优化反应条件,但第一个缺点是无法避免的。如能把RAPD与其它分子标记如RFLP、AFLP和微卫星等结合使用,RAPD仍将会发挥更好的用途。总之,随着生物技术的不断发展和更多应用,RAPD技术也将更加完善,应用更加广泛。