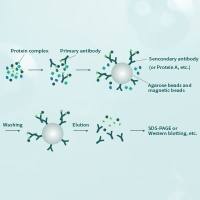
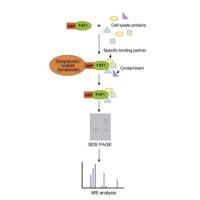
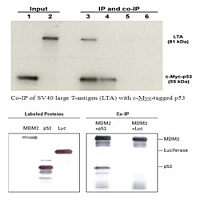
基因转染实验(磷酸钙-DNA共沉淀法)
互联网
磷酸钙- DNA 共沉淀法:
核酸以磷酸钙-DNA共沉淀物的形式出现时,可使DNA附在细胞表面,利于细胞吞入摄取,或通过 细胞膜脂相收缩时裂开的空隙进入细胞内,进入细胞的 DNA 仅有1%~5%可以进入细胞核中,其中仅有不到1%的DNA可以与细胞DNA整合,在细胞中进行稳定表达,基因转导的频率大约为10-4,这项技术能用于任何DNA导入哺乳类动物进行暂时性表达或长期转化的研究.此方法对于贴壁 细胞转染 是最常用并首选的方法.
1、配液
(1)2×HBS 1.63g NaCl
1.19g Hepes
0.023g Na2PO4.2H2O
加水至100ml pH7.1过滤,4℃保存
(2)2mmol/L CaCl2 过滤除菌
(3)TE: 0.1mmol/L EDTA
1mmol/L Tris-HCL PH8.0
(4)G418(新霉素G418)液:1g G418溶于1mmol/L Hepes液中,加H2O至10mL过滤除菌4℃保存.
(5)G418选择 培养基 :用含10%胎牛血清的DMEM培养液配制G418,G418浓度为200~ 800mg/L
注意:对受体细胞先做预试验,选用浓度为在10~14天内能杀死细胞50%以上的最低浓度.
2、操作步骤[方法一]:
(1) 供体DNA制备:
方法按前介绍的DNA提取法提取,溶于TE中,40mg/L.
(2) 受体细胞的培养:
研究癌基因转移应选择不含人类Alu序列的动物细胞系作为受体细胞.如小鼠NIH3T3胚 成纤维细胞 系等,该细胞有一定自发转化倾向,一般在转染前一天接种细胞,接种密度为2×104/cm2,用含10%胎牛血清的DMEM液,37℃、5%CO2培养,待细胞占50~70%瓶底面积时,用于转染试验.
(3) DNA-磷酸钙沉淀物的制备
① 将供体细胞DNA和PSV2-neo质粒载体DNA用TE配制成40mg/L的DNA溶液,同时向供体细胞DNA液200μl中加入带基因neo质粒DNA液(20mg/L)220μl和2×HBS 250μl(PSV2-neo为1~2mg/L的使用量).
② 取500μl上述DNA溶液加入硅化试管中,缓慢加入3.1ml、2mol/L CaCl2混匀30秒.
③ 然后立即混旋,室温下静置30分钟,待溶液轻度混浊后,吹打后即用于转染受体细胞.
(4) 转染受体细胞
① 将处于对数生长期已占瓶底50~70%的受体细胞,在转染前4小时更换一次新鲜培养基,每瓶5ml(25ml培养瓶).
② 吸取0.5mLDNA-磷酸钙沉淀,加入含5mL培养液的细胞瓶中摇匀.
③ 置37℃ 5% CO2培养24h或更长,使细胞充分吸入DNA-磷酸钙结晶颗粒.
④ 更换新鲜培养基,继续培养24小时,诱导转染基因的表达.
⑤ 更换浓度800mg/L的G418选择培养液进行筛选.同时设有未能转染的对照细胞.
⑥ 培养大约3~5天,对照细胞大部分死亡,这时转染细胞更换浓度为200mg/L的G418选择培养基,每3~4天更换一次选择培养基.
⑦ 2周后对照 细胞死亡 ,在转染的细胞瓶中可见有抗药性的细胞克隆出现,待其增大后再进行克隆化和扩大培养,可建立转化 细胞株 ,并做进一步鉴定.