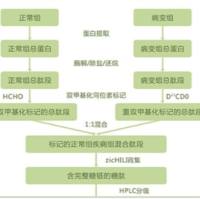
实质等同性(蛋白质组学)
丁香园
2710
1 . 引言
小麦一般是在加工成粮食产品后供人类消费,包括加工成烘焙食品( 面包、蛋糕、甜点和饼干)、面条和意大利面,以及用来制备具有特殊功能性质的调料,因而人类接触更多的是面粉或加工品而非小麦谷粒。此外,很多小麦加工品具有强烈的文化和宗教意义,使得转基因小麦与其他转基因作物相比具有更多的情感成分。
因此,建立鉴定转基因小麦的常规程序及判断其与常规育种小麦的实质等同性[ 1 ] 受到消费者和监管当局的关注[ 2 ] 。已有一些方法可用于解决这一问题[ 3 ] ,包括利用已完善的蛋白质组学分析小麦籽粒[ 4 ~ 7 ] 。该方法也已应用于其他转基因作物以确定其实质等同性[ 8~ 10]。
由于蛋白质组成是动态的,取决于取样时的内外环境,因此对于任何供试细胞都无法确定其完整的蛋白质组。同时,不同蛋白质组分在数量上的巨大差异也使得鉴定和定量分析微量蛋白组分常难以实现。尽管如此,以小麦和其他谷类作物为材料的蛋白质组学研究已取得实质性进展。
在蛋白质组学研究中,双向电泳是分离蛋白质的传统方法,也是大多数小麦研究中仍旧使用的方法 [ 4 ~ 7 ] ,虽然目前不少实验室已应用二维液相色谱- 质谱联用技术( 2DLC - MS ) 替代双向电泳或与双向电泳并用。这两种技术互为补充,通常鉴定的是不同的蛋白质。然而,2DLC - MS 的费用限制了其在很多实验室的使用,因此双向电泳仍然是最广泛应用且容易获得的技术。固相 pH 梯度胶条的发展使得双向电泳对技术的要求大大降低,重复性大大提高。然而,双向电泳技术仍存在很多局限性,如难以分离膜蛋白、带高价电荷 ( 碱性或酸性)蛋白和高分子质量蛋白。此外,当高丰度组分存在时,低丰度蛋白难以鉴定。这一问题在小麦谷粒中尤为明显,若采用全蛋白提取法,主要储藏蛋白会掩盖很多其他蛋白质。但是,细胞分级分离或连续萃取法,或通过选用合适的限制性 pH 梯度,能在很大程度上克服这些问题。
以下描述的是基于包括我们实验室在内的若干实验室所采用的方法。
2. 材料
所有化学药品必须是高质量的,如果可能的话,用 AristaR 级。如无特别标明,供应 商均为 Sigma、 Poole、Dorset、U K。
2.1 提取缓冲液
( 1 ) 适用于白面粉:5 mmol/L 氨基丁三醇 (Trizmabase) ,1 mmol/L CaCl2,不需调节 pH。
( 2 ) 总蛋白提取缓冲液:2 mol/L 硫脲( thiourea ) , 7 mol/L 尿素 (urea) , 1%(m/V)二硫苏糖醇(DTT ) ,2% ( m/V)CHAPS,0.5% IPG-缓冲液,pH 3~10 ( GEHealthcare,UK )。
( 3 ) Osborne 分级缓冲液:水饱和正丁醇(50 ml 正丁醇加水 5 ml,摇晃,静置分层,取上层),0.5 mol/L NaCl,70%(V/V)乙醇,50%(V/V)丙醇,2%(V/V)β-巯基乙醇,1%(V/V)冰醋酸;5%(V/V)冰醋酸。
( 4 ) 酸:丙酮沉淀缓冲液
溶液 I : 含 10% (m/V) TCA、0.07 %(m/V) DTT 的丙酮
提取蛋白前 1 天准备 10% TCA,用前在 -20℃ 冰箱中至少储存 12 h。新鲜的 DTT 于使用当天加入。
溶液II : 含 0.07%(m/V)DTT 的丙酮提取前 1 天将丙酮储藏于 -20°C,用前至少储存 12 h。新鲜的 DTT 于使用当天加入。
使用后弃去配好的溶液,在随后的提取中配制新的溶液。
2.2 等电聚焦 (IEF )
( 1 ) 水化液:7 mol/L 尿素(urea ) ,2 mol/L 硫脲( thiourea ) ,2% ( m/V ) CHAPS , 40 mmol/L 二硫苏糖醇 ( DTT ) , 0.5% IPG 两性电解质 (适宜 pH ) ,痕量溴酚蓝。
( 2 ) DryStrip 覆盖油(GE Healthcare, U K )。
( 3 ) ImmobilineDryStrips 干胶条(GE Healthcare,UK ) 。
( 4 ) 电极滤纸片(GE Healthcare, UK ) 。
( 5 ) 平衡液:50 mmol/L Tris-HCl pH 8 .8, 6 mol/L 尿素,2% (m/V) SDS,30%(V/V)甘油,痕量溴酸蓝。将 1% ( m/V)DTT 或 4% (m/V ) 碘乙酰胺(iodoacetamide) 加到新鲜配制的平衡液中( 还原和脲甲基化)。
2.3 SDS- 聚丙烯酰胺凝胶电泳(SDS- PAGE)
( 1 ) Tris-HCl ( 1.5 mol/L), pH 8.8。
( 2 ) SDS ( 10%, m/V )。
( 3 ) 过硫酸铵( APS ,10%, m /V)用前现配。
( 4 ) N,N,N',N'-四甲基乙二胺( TEMED )。
( 5 ) 水饱和正丁醇。
( 6 ) “丙烯酰胺”储液:30% Duracryl (丙烯酰胺),0.65% Bis (甲叉双丙烯酰胺)( Proteomic Solutions,France )。
( 7 ) 底槽液:25 mmol/L Trizma base ; 0.015 mol/L 冰醋酸。
( 8 ) 上槽液:0.2 mol/L Trizma base ; 0.2 mol/L Tricine;0.4% ( m/V) SDS。
( 9 ) 置换液:0.375 mol/L Tris - HCl,pH 8.8,50%(V/V)甘油,痕量溴酚蓝。
2.4 凝胶染色
2.4.1 考马斯亮蓝 G - 250
( 1 ) 固定 : 50%(V/V)甲醇,10%(m/V)TCA 。
( 2 ) 脱色: 25%(V/V) 甲醇,7%(V/V)乙酸。
( 3 ) 漂洗: 25%(V/V)甲醇。
( 4 ) 染色液:17%(m/V)硫酸铵,34%(V/V)甲醇,0.5%(V/V)乙酸,0.1%(m/V)考马斯亮蓝 G-250。通常购买预制储液(如从 Sigma 购买),加 800 ml 水稀释到 1 L,然后取 40 ml 稀释的染色液加入 10 ml 甲醇 ( 见注 1 关于固定谷蛋白)。
2.4.2 银染
( 1 ) 固定:40%(V/V)乙醇,10%(V/V)乙酸 [ 若固定谷粒蛋白,则以 10%(m/V)TCA 替代 ]。
( 2 ) 敏化液:30%(V/V)乙醇,0.2%(m/V)硫代硫酸钠,0.5 mol/L 乙酸钠。
( 3 ) 银染液:0.25%(m/V)硝酸银。
( 4 ) 显影液:0.24 mol/L 碳酸钠,200 μl 的 37% 甲醛(终浓度 0.0074% )。
( 5 ) 终止液:0.04 mol/L EDTA 。
2.4.3 Sypro Ruby 蛋白染色( BioRad , UK )
( 1 ) 固定 :10%(V/V)甲醇,10%(V/V)TCA 。
( 2 ) Sypro Ruby 蛋白染液。
( 3 ) 脱色液:10%(V/V)甲醇,6%(m/V)TCA 。
2.5 酶消化和质谱分析前的凝 胶脱色
2.5.1 考马斯和 Sypro - 染色后的凝胶块
( 1 ) 水
( 2 ) 乙腈( acetonitrile )
( 3 ) NH4HCO3 ( 0.1 mol/L )
2.5.2 银染后的凝胶块
硫代硫酸钠 [ sodium thiosulphate,20% ] 、铁氰化钾 [ potassium ferricyanide 1%(m/V) ] 和水以 1: 1: 1 混合。
2.6 还原和烷基化(脲甲基化)
( 1 ) DTT ( 10 mmol/L )
( 2 ) 碘乙酰胺(55 mmol/L )
( 3 ) NH4HCO3 ( 0.1 mol/L )
2.7 酶消化
( 1 ) 胰蛋白酶酶解缓冲液:25 mmol/L NH4HCO3,5 mmol/L CaCl2。
( 2 ) 胰蛋白酶浓度 0.125 μg/μl ( Promega UK ) ( 见注 2 ) 。
2.8 多肽脱盐及富集
C-18 Zip tip 吸管尖(Millipore )
2.8.1 MALDI - MS ( 基质辅助激光解吸电离-质谱)
( 1 ) 润湿液:1 : 1 乙腈(acetonitrile ) :水
( 2 ) 样品液: 0.1%(V/V)三氟乙酸(TFA ) 水溶液
( 3 ) 平衡液: 0.1%(V/V)TFA 水溶液
( 4 ) 洗涤液: 0.1%(V/V)TFA 水溶液
( 5 ) 洗脱液: 1 : 1 乙腈 :水溶液配制 0.1%(V/V)TFA
2.8.2 ESI-MS ( 电喷雾-质谱)
( 1 ) 浸润液:1%(V/V)甲酸
( 2 ) 样品液:含 1%(V/V)甲酸的 4%(V/V)甲醇
( 3 ) 洗涤液:1%(V/V)甲酸
( 4 ) 洗脱液:含 1%(V/V)甲酸的 70%(V/V)甲醇
2.9 MALDI 目标点样
( 1 ) 含 49.5%(V/V)乙腈、49.5% (V/V)乙醇、1%(V/V)0.1% TFA 溶液配制 2 mg/ml α- 氨基- 4 - 烃基肉桂酸 (α- cyano- 4 - hydroxycinnamic acid)。
( 2 ) 胰蛋白酶酶解产物,如乙醇脱氢酶( ADH ) 的酶切产物。
3. 注释
注 1 : 由于谷物储藏蛋白可能溶于乙酸溶液,固定这类蛋白质需用 TCA 代替乙酸。
注 2 : 用 50 mmol/L 乙酸溶解胰蛋白酶,分成小份,储存于取一小份加入酶解缓冲液,工作浓度约为 0.125 μg/μl。
注 3 : 沉淀 Rubisco [ 16 ] : 加入 60% PEG(m/V ) 使最终 PEG 浓度为 20%(m/V ) ( 如每 10 ml 提取物加 3.75 ml 60% PEG 4000 )。按每 10 ml 提取物加 0.2 ml 的比例加 1 mol/L MgCl2,轻柔混匀,置混合物于冰上至少 10 min。Rubisco 可通过离心去除。
注 4 : 为了在胶条槽(strip holders ) 直接水化干胶条,胶面朝下置于水化液 (含样品)中,确保没有气泡存在。用矿物油覆盖,盖上盖子。将胶条槽放入 IPGPhor,水化 16~18 h,然后直接进入 IEF 程序。IEF 结束后移开胶条,去除多余矿物油,冻于 - 80℃ 或如第 3.3 节(凝胶电泳)步骤 5 所述,在还原和烷化后用于第二向胶。
注 5 : 组装后可用硅密封胶密封板边缘。如使用硅密封胶,需要 3~4 天使密封胶凝固。凝胶电泳完毕后,清洗玻璃板前必须用刀片除去密封胶。
注 6 : 胶体考马斯灵敏度约 100 ng 水平,而银染和荧光染料可检测到 10~50 ng 的水平(取决于你信任哪篇文献)。
注 7 : 如不需要凝胶匹配,则 Sypro Ruby 可使用超过一次。如需要凝胶匹配,最好使用新鲜的 Sypro Ruby,因为重复使用可能在胶上产生斑点。Sypro Ruby 清理:没有资料表明 Sypro Ruby 蛋白凝胶染色的毒性。染剂含有有机成分和重金属成分( 钌)。关于清理,Sypro Ruby 溶液需用小量冰醋酸酸化,灌注通过活性炭或其他 可燃材料,然后在装有适宜的补燃器/洗涤器系统的化学焚化炉中燃烧以去除染料。当处理燃料时,应予遵守联邦、州和地方政府的所有环境条例。
参考文献
1. Safety Evaluation of Foods Derived Through Modern Biotechnology: Concepts and Principles ( 1993) OECD,Paris.
2. Kuiper, H. A., Kleter, G. A., Noteborn, H. P. J. M. and Kok, E. S. (2001) Assessment of the food safetyissues related to genetically modified foods. Plant J. 27, 503-528.
3. Shewry, P. R ., Baudo, M., Lovegrove, A., Napier, J . , Ward, J . , Baker, J. and Beale, M. (2007) AreGM and conventionally bred cereals really different ? Trends Food ScL Technol. 18, 201 -209.
4. Skylas, D. J . , Mackintosh, J. A., Cordwell, S. J . , Basseal, D. J . , Walsh, B. J . , Harry, J . , Blumenthal,C., Copeland, L ., Wrigley, C. W. and Rathmell, W. (2000) Proteome approach to the characterisation ofprotein composition in the developing and mature wheat-grain endosperm. /. Cereal ScL 32, 169-188.
5. Amiour, N ., Merlino, M ., Leroy, P. and Branlard, G. (2002) Proteomic analysis of amphiphilic proteinsof hexaploid wheat. Proteomics 2 , 632-6 4 1.
6. Salt, L. J . , Robertson, J. A., Jenkins, J. A., Mulholland, F. and Mills, E. N. C. (2005) The identification of foam-forming soluble proteins from wheat ( Triticum aestivum) dough. Proteomics 5, 1612-1623.
7. Vensel, W. H ., Tanaka, C. K ., Cari, N ., Wong, J. H ., Buchanan, B. B. and Hurkman, W. J. (2005)Developmental changes in the metabolic protein profiles of wheat endosperm. Proteomics 5, 159 4-1611.
8. Ruebelt, M. C., Leimgruber, N. K ., Lipp, M ., Reynolds, T. L ., Nemeth, M. A., Astwood, J. D ., Engel,K. -H. and Jany, K. -D. (2006) Application of two-dimensional gel electrophoresis to interrogate alterationsin the proteome of genetically modified crops. 1. Assessing analytical variation. J. Agr. Food Chem. 5 4 ,2154-2161.
9. Ruebelt, M. C., Lipp, M., Reynolds, T. L ., Astwood, J. D ., Engell, K. -H. and Jany, K. -D. (2006) Application of two-dimensional gel electrophoresis to interrogate alterations in the proteome of geneticallymodified crops. Assessing natural variability. J. Agr. Food Chem. 5 4 , 2162-2168.
10. Ruebelt, M. C., Lipp, M ., Reynolds, T. L ., Schmuke, J. J . , Astwood, J. D ., DellaPenna, D ., Engel,K. -H. and Jany, K. -D. (2006) Application of two-dimensional gel electrophoresis to interrogate alterations in the proteome of genetically modified crops. 1. Assessing unintended effects. /. Agr. Food Chem. 5 4 ,2169-2177.
11. Finnie, C ., Mechior, S ., Roepstorff, P. and Svensson, B. (2002) Proteome analysis of grain filling andseed maturation in barley. Plant Physiol. 129, 1308-1319.
12. Osborne, T. B. (1907) The Proteins o f the Wheat Kernel. Publication No 8 4 , Carnegie Institute.
13. Yan, J. X., Wait, R ., Berkelman, T ., Harry, R. A., Westbrook, J. A., Wheeler, C. H. and Dunn, M.J. (2000) A modified silver staining protocol for visualization of proteins compatible with matrix-assisted la-ser desorption/ionization and electrospray ionization-mass spectrometry. 2 1 , 3666-3672.
14. Jensen, 0 . N ., Wilm, M., Shevchenko, A. and Mann, M. (1999) Sample preparation methods for massspectrometric peptide mapping directly from 2-DE gels, in. 2-D Proteome Analysis Protocols, ( Link, A .,ed.) , Methods in Molecular Biology Series, Vol. 112, Humana Press, Totowa, pp. 513-530.
15. Kristensen, D. B ., Imamura, K ., Miyamoto, Y. and Yoshizato, K. (2000) Mass spectrometric approachesfor the characterisation of proteins on a hybrid quadrupole time-offlight ( Q-Tof) mass spectrometer. Electrophoresis 21, 430-4 39.
16. Hall, N. P. and Tolbert, N. E. ( 1978) A rapid procedure for the isolation of Rubisco from spinach leaves.FEBS Lett. 96 167-169.
小麦一般是在加工成粮食产品后供人类消费,包括加工成烘焙食品( 面包、蛋糕、甜点和饼干)、面条和意大利面,以及用来制备具有特殊功能性质的调料,因而人类接触更多的是面粉或加工品而非小麦谷粒。此外,很多小麦加工品具有强烈的文化和宗教意义,使得转基因小麦与其他转基因作物相比具有更多的情感成分。
因此,建立鉴定转基因小麦的常规程序及判断其与常规育种小麦的实质等同性[ 1 ] 受到消费者和监管当局的关注[ 2 ] 。已有一些方法可用于解决这一问题[ 3 ] ,包括利用已完善的蛋白质组学分析小麦籽粒[ 4 ~ 7 ] 。该方法也已应用于其他转基因作物以确定其实质等同性[ 8~ 10]。
由于蛋白质组成是动态的,取决于取样时的内外环境,因此对于任何供试细胞都无法确定其完整的蛋白质组。同时,不同蛋白质组分在数量上的巨大差异也使得鉴定和定量分析微量蛋白组分常难以实现。尽管如此,以小麦和其他谷类作物为材料的蛋白质组学研究已取得实质性进展。
在蛋白质组学研究中,双向电泳是分离蛋白质的传统方法,也是大多数小麦研究中仍旧使用的方法 [ 4 ~ 7 ] ,虽然目前不少实验室已应用二维液相色谱- 质谱联用技术( 2DLC - MS ) 替代双向电泳或与双向电泳并用。这两种技术互为补充,通常鉴定的是不同的蛋白质。然而,2DLC - MS 的费用限制了其在很多实验室的使用,因此双向电泳仍然是最广泛应用且容易获得的技术。固相 pH 梯度胶条的发展使得双向电泳对技术的要求大大降低,重复性大大提高。然而,双向电泳技术仍存在很多局限性,如难以分离膜蛋白、带高价电荷 ( 碱性或酸性)蛋白和高分子质量蛋白。此外,当高丰度组分存在时,低丰度蛋白难以鉴定。这一问题在小麦谷粒中尤为明显,若采用全蛋白提取法,主要储藏蛋白会掩盖很多其他蛋白质。但是,细胞分级分离或连续萃取法,或通过选用合适的限制性 pH 梯度,能在很大程度上克服这些问题。
以下描述的是基于包括我们实验室在内的若干实验室所采用的方法。
2. 材料
所有化学药品必须是高质量的,如果可能的话,用 AristaR 级。如无特别标明,供应 商均为 Sigma、 Poole、Dorset、U K。
2.1 提取缓冲液
( 1 ) 适用于白面粉:5 mmol/L 氨基丁三醇 (Trizmabase) ,1 mmol/L CaCl2,不需调节 pH。
( 2 ) 总蛋白提取缓冲液:2 mol/L 硫脲( thiourea ) , 7 mol/L 尿素 (urea) , 1%(m/V)二硫苏糖醇(DTT ) ,2% ( m/V)CHAPS,0.5% IPG-缓冲液,pH 3~10 ( GEHealthcare,UK )。
( 3 ) Osborne 分级缓冲液:水饱和正丁醇(50 ml 正丁醇加水 5 ml,摇晃,静置分层,取上层),0.5 mol/L NaCl,70%(V/V)乙醇,50%(V/V)丙醇,2%(V/V)β-巯基乙醇,1%(V/V)冰醋酸;5%(V/V)冰醋酸。
( 4 ) 酸:丙酮沉淀缓冲液
溶液 I : 含 10% (m/V) TCA、0.07 %(m/V) DTT 的丙酮
提取蛋白前 1 天准备 10% TCA,用前在 -20℃ 冰箱中至少储存 12 h。新鲜的 DTT 于使用当天加入。
溶液II : 含 0.07%(m/V)DTT 的丙酮提取前 1 天将丙酮储藏于 -20°C,用前至少储存 12 h。新鲜的 DTT 于使用当天加入。
使用后弃去配好的溶液,在随后的提取中配制新的溶液。
2.2 等电聚焦 (IEF )
( 1 ) 水化液:7 mol/L 尿素(urea ) ,2 mol/L 硫脲( thiourea ) ,2% ( m/V ) CHAPS , 40 mmol/L 二硫苏糖醇 ( DTT ) , 0.5% IPG 两性电解质 (适宜 pH ) ,痕量溴酚蓝。
( 2 ) DryStrip 覆盖油(GE Healthcare, U K )。
( 3 ) ImmobilineDryStrips 干胶条(GE Healthcare,UK ) 。
( 4 ) 电极滤纸片(GE Healthcare, UK ) 。
( 5 ) 平衡液:50 mmol/L Tris-HCl pH 8 .8, 6 mol/L 尿素,2% (m/V) SDS,30%(V/V)甘油,痕量溴酸蓝。将 1% ( m/V)DTT 或 4% (m/V ) 碘乙酰胺(iodoacetamide) 加到新鲜配制的平衡液中( 还原和脲甲基化)。
2.3 SDS- 聚丙烯酰胺凝胶电泳(SDS- PAGE)
( 1 ) Tris-HCl ( 1.5 mol/L), pH 8.8。
( 2 ) SDS ( 10%, m/V )。
( 3 ) 过硫酸铵( APS ,10%, m /V)用前现配。
( 4 ) N,N,N',N'-四甲基乙二胺( TEMED )。
( 5 ) 水饱和正丁醇。
( 6 ) “丙烯酰胺”储液:30% Duracryl (丙烯酰胺),0.65% Bis (甲叉双丙烯酰胺)( Proteomic Solutions,France )。
( 7 ) 底槽液:25 mmol/L Trizma base ; 0.015 mol/L 冰醋酸。
( 8 ) 上槽液:0.2 mol/L Trizma base ; 0.2 mol/L Tricine;0.4% ( m/V) SDS。
( 9 ) 置换液:0.375 mol/L Tris - HCl,pH 8.8,50%(V/V)甘油,痕量溴酚蓝。
2.4 凝胶染色
2.4.1 考马斯亮蓝 G - 250
( 1 ) 固定 : 50%(V/V)甲醇,10%(m/V)TCA 。
( 2 ) 脱色: 25%(V/V) 甲醇,7%(V/V)乙酸。
( 3 ) 漂洗: 25%(V/V)甲醇。
( 4 ) 染色液:17%(m/V)硫酸铵,34%(V/V)甲醇,0.5%(V/V)乙酸,0.1%(m/V)考马斯亮蓝 G-250。通常购买预制储液(如从 Sigma 购买),加 800 ml 水稀释到 1 L,然后取 40 ml 稀释的染色液加入 10 ml 甲醇 ( 见注 1 关于固定谷蛋白)。
2.4.2 银染
( 1 ) 固定:40%(V/V)乙醇,10%(V/V)乙酸 [ 若固定谷粒蛋白,则以 10%(m/V)TCA 替代 ]。
( 2 ) 敏化液:30%(V/V)乙醇,0.2%(m/V)硫代硫酸钠,0.5 mol/L 乙酸钠。
( 3 ) 银染液:0.25%(m/V)硝酸银。
( 4 ) 显影液:0.24 mol/L 碳酸钠,200 μl 的 37% 甲醛(终浓度 0.0074% )。
( 5 ) 终止液:0.04 mol/L EDTA 。
2.4.3 Sypro Ruby 蛋白染色( BioRad , UK )
( 1 ) 固定 :10%(V/V)甲醇,10%(V/V)TCA 。
( 2 ) Sypro Ruby 蛋白染液。
( 3 ) 脱色液:10%(V/V)甲醇,6%(m/V)TCA 。
2.5 酶消化和质谱分析前的凝 胶脱色
2.5.1 考马斯和 Sypro - 染色后的凝胶块
( 1 ) 水
( 2 ) 乙腈( acetonitrile )
( 3 ) NH4HCO3 ( 0.1 mol/L )
2.5.2 银染后的凝胶块
硫代硫酸钠 [ sodium thiosulphate,20% ] 、铁氰化钾 [ potassium ferricyanide 1%(m/V) ] 和水以 1: 1: 1 混合。
2.6 还原和烷基化(脲甲基化)
( 1 ) DTT ( 10 mmol/L )
( 2 ) 碘乙酰胺(55 mmol/L )
( 3 ) NH4HCO3 ( 0.1 mol/L )
2.7 酶消化
( 1 ) 胰蛋白酶酶解缓冲液:25 mmol/L NH4HCO3,5 mmol/L CaCl2。
( 2 ) 胰蛋白酶浓度 0.125 μg/μl ( Promega UK ) ( 见注 2 ) 。
2.8 多肽脱盐及富集
C-18 Zip tip 吸管尖(Millipore )
2.8.1 MALDI - MS ( 基质辅助激光解吸电离-质谱)
( 1 ) 润湿液:1 : 1 乙腈(acetonitrile ) :水
( 2 ) 样品液: 0.1%(V/V)三氟乙酸(TFA ) 水溶液
( 3 ) 平衡液: 0.1%(V/V)TFA 水溶液
( 4 ) 洗涤液: 0.1%(V/V)TFA 水溶液
( 5 ) 洗脱液: 1 : 1 乙腈 :水溶液配制 0.1%(V/V)TFA
2.8.2 ESI-MS ( 电喷雾-质谱)
( 1 ) 浸润液:1%(V/V)甲酸
( 2 ) 样品液:含 1%(V/V)甲酸的 4%(V/V)甲醇
( 3 ) 洗涤液:1%(V/V)甲酸
( 4 ) 洗脱液:含 1%(V/V)甲酸的 70%(V/V)甲醇
2.9 MALDI 目标点样
( 1 ) 含 49.5%(V/V)乙腈、49.5% (V/V)乙醇、1%(V/V)0.1% TFA 溶液配制 2 mg/ml α- 氨基- 4 - 烃基肉桂酸 (α- cyano- 4 - hydroxycinnamic acid)。
( 2 ) 胰蛋白酶酶解产物,如乙醇脱氢酶( ADH ) 的酶切产物。
3. 注释
注 1 : 由于谷物储藏蛋白可能溶于乙酸溶液,固定这类蛋白质需用 TCA 代替乙酸。
注 2 : 用 50 mmol/L 乙酸溶解胰蛋白酶,分成小份,储存于取一小份加入酶解缓冲液,工作浓度约为 0.125 μg/μl。
注 3 : 沉淀 Rubisco [ 16 ] : 加入 60% PEG(m/V ) 使最终 PEG 浓度为 20%(m/V ) ( 如每 10 ml 提取物加 3.75 ml 60% PEG 4000 )。按每 10 ml 提取物加 0.2 ml 的比例加 1 mol/L MgCl2,轻柔混匀,置混合物于冰上至少 10 min。Rubisco 可通过离心去除。
注 4 : 为了在胶条槽(strip holders ) 直接水化干胶条,胶面朝下置于水化液 (含样品)中,确保没有气泡存在。用矿物油覆盖,盖上盖子。将胶条槽放入 IPGPhor,水化 16~18 h,然后直接进入 IEF 程序。IEF 结束后移开胶条,去除多余矿物油,冻于 - 80℃ 或如第 3.3 节(凝胶电泳)步骤 5 所述,在还原和烷化后用于第二向胶。
注 5 : 组装后可用硅密封胶密封板边缘。如使用硅密封胶,需要 3~4 天使密封胶凝固。凝胶电泳完毕后,清洗玻璃板前必须用刀片除去密封胶。
注 6 : 胶体考马斯灵敏度约 100 ng 水平,而银染和荧光染料可检测到 10~50 ng 的水平(取决于你信任哪篇文献)。
注 7 : 如不需要凝胶匹配,则 Sypro Ruby 可使用超过一次。如需要凝胶匹配,最好使用新鲜的 Sypro Ruby,因为重复使用可能在胶上产生斑点。Sypro Ruby 清理:没有资料表明 Sypro Ruby 蛋白凝胶染色的毒性。染剂含有有机成分和重金属成分( 钌)。关于清理,Sypro Ruby 溶液需用小量冰醋酸酸化,灌注通过活性炭或其他 可燃材料,然后在装有适宜的补燃器/洗涤器系统的化学焚化炉中燃烧以去除染料。当处理燃料时,应予遵守联邦、州和地方政府的所有环境条例。
参考文献
1. Safety Evaluation of Foods Derived Through Modern Biotechnology: Concepts and Principles ( 1993) OECD,Paris.
2. Kuiper, H. A., Kleter, G. A., Noteborn, H. P. J. M. and Kok, E. S. (2001) Assessment of the food safetyissues related to genetically modified foods. Plant J. 27, 503-528.
3. Shewry, P. R ., Baudo, M., Lovegrove, A., Napier, J . , Ward, J . , Baker, J. and Beale, M. (2007) AreGM and conventionally bred cereals really different ? Trends Food ScL Technol. 18, 201 -209.
4. Skylas, D. J . , Mackintosh, J. A., Cordwell, S. J . , Basseal, D. J . , Walsh, B. J . , Harry, J . , Blumenthal,C., Copeland, L ., Wrigley, C. W. and Rathmell, W. (2000) Proteome approach to the characterisation ofprotein composition in the developing and mature wheat-grain endosperm. /. Cereal ScL 32, 169-188.
5. Amiour, N ., Merlino, M ., Leroy, P. and Branlard, G. (2002) Proteomic analysis of amphiphilic proteinsof hexaploid wheat. Proteomics 2 , 632-6 4 1.
6. Salt, L. J . , Robertson, J. A., Jenkins, J. A., Mulholland, F. and Mills, E. N. C. (2005) The identification of foam-forming soluble proteins from wheat ( Triticum aestivum) dough. Proteomics 5, 1612-1623.
7. Vensel, W. H ., Tanaka, C. K ., Cari, N ., Wong, J. H ., Buchanan, B. B. and Hurkman, W. J. (2005)Developmental changes in the metabolic protein profiles of wheat endosperm. Proteomics 5, 159 4-1611.
8. Ruebelt, M. C., Leimgruber, N. K ., Lipp, M ., Reynolds, T. L ., Nemeth, M. A., Astwood, J. D ., Engel,K. -H. and Jany, K. -D. (2006) Application of two-dimensional gel electrophoresis to interrogate alterationsin the proteome of genetically modified crops. 1. Assessing analytical variation. J. Agr. Food Chem. 5 4 ,2154-2161.
9. Ruebelt, M. C., Lipp, M., Reynolds, T. L ., Astwood, J. D ., Engell, K. -H. and Jany, K. -D. (2006) Application of two-dimensional gel electrophoresis to interrogate alterations in the proteome of geneticallymodified crops. Assessing natural variability. J. Agr. Food Chem. 5 4 , 2162-2168.
10. Ruebelt, M. C., Lipp, M ., Reynolds, T. L ., Schmuke, J. J . , Astwood, J. D ., DellaPenna, D ., Engel,K. -H. and Jany, K. -D. (2006) Application of two-dimensional gel electrophoresis to interrogate alterations in the proteome of genetically modified crops. 1. Assessing unintended effects. /. Agr. Food Chem. 5 4 ,2169-2177.
11. Finnie, C ., Mechior, S ., Roepstorff, P. and Svensson, B. (2002) Proteome analysis of grain filling andseed maturation in barley. Plant Physiol. 129, 1308-1319.
12. Osborne, T. B. (1907) The Proteins o f the Wheat Kernel. Publication No 8 4 , Carnegie Institute.
13. Yan, J. X., Wait, R ., Berkelman, T ., Harry, R. A., Westbrook, J. A., Wheeler, C. H. and Dunn, M.J. (2000) A modified silver staining protocol for visualization of proteins compatible with matrix-assisted la-ser desorption/ionization and electrospray ionization-mass spectrometry. 2 1 , 3666-3672.
14. Jensen, 0 . N ., Wilm, M., Shevchenko, A. and Mann, M. (1999) Sample preparation methods for massspectrometric peptide mapping directly from 2-DE gels, in. 2-D Proteome Analysis Protocols, ( Link, A .,ed.) , Methods in Molecular Biology Series, Vol. 112, Humana Press, Totowa, pp. 513-530.
15. Kristensen, D. B ., Imamura, K ., Miyamoto, Y. and Yoshizato, K. (2000) Mass spectrometric approachesfor the characterisation of proteins on a hybrid quadrupole time-offlight ( Q-Tof) mass spectrometer. Electrophoresis 21, 430-4 39.
16. Hall, N. P. and Tolbert, N. E. ( 1978) A rapid procedure for the isolation of Rubisco from spinach leaves.FEBS Lett. 96 167-169.