【原创】说一说我用Gateway的经验兼答疑
丁香园论坛
进了新实验室后一直用Gateway做克隆,发现论坛上很少有讨论gateway的帖子,特开此贴,也欢迎对gateway有经验,有兴趣和有疑问的同行们一起交流经验
Gateway官方简介: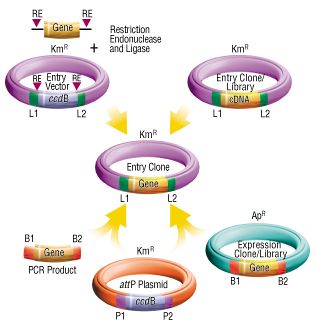
Gateway®克隆技术的基础是lambda噬菌体的位点特异性重组反应,一种准确保存遗传信息的有效的自然的生化途径。与传统的需要DNA限制性内切酶、DNA连接酶、凝胶电泳和Dundefined*段纯化等多个步骤的单调乏味的亚克隆方法相比,该方法只需一步生化反应而且操作方便、快捷(室温60分钟),节省了大量的时间和劳力。另外,根据目的蛋白的生产和纯化的不同要求, Invitrogen公司提供一系列含有不同启动子和融合标签、以及在几种宿主表达的目标载体。
以下是个人总结
优点:
1. 效率高,空载体含有毒性基因所以避免了大部分的假阳性。
2. 在不同载体之间转换方便,省去了大量的酶切/胶回收/去磷酸/连接的步骤,尤其适合筛选大量基因和突变体的应用。
3. 速度快,大部分反应1小时完成而且转化效率很高,自制的感受态DH10B(1ug=10^8cfu)加1ul反应产物就可以。
4. 反应缓冲液是TE,可以直接电转化
5. 兼容TOPO,可以用CmR/ccdB片断构建载体
6. 个人感觉容错率较高,对时间和温度的控制要求也不严。一开始没经验,用水浴加温,拿出来发现一个EP管里的液量神奇的增加了,应该是进了水。硬着头皮继续做居然成功了。
缺点:
1. 酶很贵,真的很贵
2. 很贵的酶还很娇贵,冰上几分钟就有可能失活。虽然现行版本的酶经过改进只需要零下20度但是为了以防万一还是推荐零下80度保存。
3. 10kb以上的片断需要隔夜培育,和传统的酶切-T4连接相比没有优势
4. 载体选择比前几年多但是依然较少,invitrogen的质粒很贵,自己构建和扩增载体较繁琐而且需要抗ccdB的特殊菌株来转化。
下面说一些手册里没有的小技巧
1. 手册里的反应体系是10ul, 其实完全可以减半, 不影响效果。2.5ul的体系试过但是因为体积太小所以可重复性较差,不推荐。手册里的一步反应法也很奢侈,实际操作中BP反应产物直接取2ul加入LR反应体系即可。
2. BP反应试剂盒里的阳性控制不推荐,一来检测麻烦(需要四环素平板),二来没有必要还浪费酶。BP反应后可以取1ul产物用M13测序引物做PCR然后跑胶。正常情况下应该能扩出两个条带: 1.7kb的一条是空白载体上的cmR和ccdB片断,而另一段的长度应该等同于Attb片断的长度。反应完全的情况下两个条带的亮度应该差不多(BP反应是可逆的)。如果目的基因的条带很暗的话可以适当增加转化用的产物量或者选用好一些的感受态菌株。
3. PCR反应要先纯化否则残余引物会影响反应。BP试剂盒里的PCR纯化剂(PEG8000/MgCL2)效果不错但是离心后很难看到DNA沉淀,只能按照感觉吸去上清然后加入TE测定核酸含量判断有没有回收成功。普通的硅胶离心柱纯化法贵一些,但是相对可靠。
4. 手册里说BP反应里的AttB片断必须是线性的,如果用质粒必须做酶切,但是事实证明用超螺旋的质粒结果没有区别。
5. 同理,用引物在目的基因上下游加入AttL序列后直接进行LR反应也是可行的,可以省去BP反应相关的材料和费用。但是pDONR系列载体自有其优点(载体小,拷贝数高,卡那霉素抗性,容易测序),所以要按实际情况权衡
6. 慢病毒载体的空白质粒有大量的重复序列,久存会导致LR反应成功但是转化后抽不出质粒的情况,需要注意。