荧光定量 PCR 的常见异常结果除了扩增曲线异常、融解曲线异常两类常见情况外,qPCR 实验中通常还会遇到以下三大类情况:
1. 复孔间重复性差怎么办?
复孔间重复性差一般会有以下两种情况:
(1)CT 值很大,如 CT≥ 30,重复性差属于正常现象。该现象符合泊松分布,即在有效模板量很少的情况下,模板与引物的碰撞存在随机性,直接导致复孔间的 CT 值差异较大。
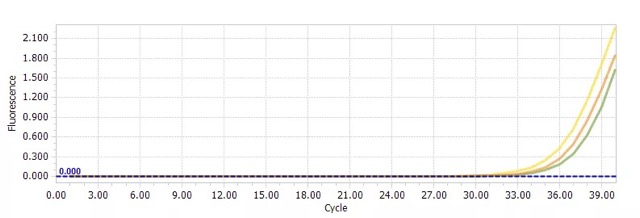
解决方法:如果融解曲线没有杂峰,无模板阴性对照同目的基因的 △CT 值为 3 or 5 以上,那 CT 值为准确的,可多设置几个复孔,选择重复性好的 CT 值参与计算。
(2)CT<30,重复性较差。这种情况一般同操作有关。
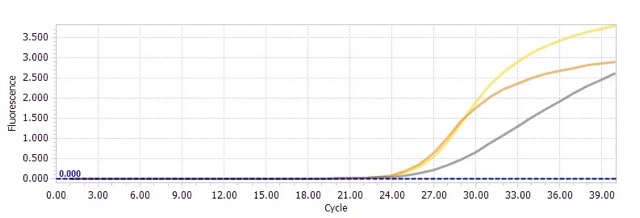
解决办法:从以下几个方面进行问题的排查:①加样准确度;②移液器吸取液体的准确度;③定期校准 qPCR 仪。
①加样准确度
-
避免小体积加样,减少加样误差。可以将引物、SYBR Green Mix、ddH2O 配置成混合体系,并且增加模板的稀释梯度,大体积加样。如:原液 cDNA 添加 1μl,可以更改为原液 cDNA 稀释 5 倍,添加 5μl,使用 ddH2O 补齐体系至 20μl 即可。
-
SYBR Green Mix、配置的混合体系需要混合均匀。从 -20℃ 冰箱拿出的试剂需要完全融化并上下颠倒彻底混匀;配置体系时,将混在一起的 Mix 用移液器吹打混匀。
②移液器吸取液体的准确度
-
移液器量程定期校准,校准周期为 1 年。
-
购买与移液器配套的枪头,若枪头与移液器不匹配,在吸取液体时易出现漏气的现象,导致吸取量程不准确。
-
在吸取相同量程的液体体积时,注意观察每次吸取液体在枪头内的液面高度是否一致。
③定期校准 qPCR 仪
-
一般 qPCR 仪校准周期为一年。
2. NTC(无模板阴性对照)出现 CT 值,目的基因的 CT 值还能使用吗?
NTC(无模板阴性对照)出现扩增一般会有两种情况:
(1)通过观察融解曲线,NTC 与目的基因融解曲线峰形不重叠。一般 NTC 的 Tm 值较目的基因 Tm 值小。
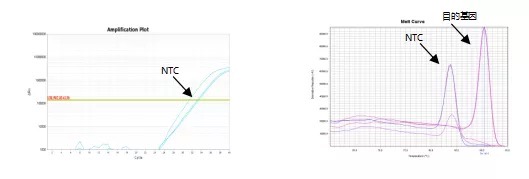
这种情况下,NTC 的 CT 值是由引物二聚体造成的,并不影响目的基因 CT 值的采集。
(2)NTC 与目的基因融解曲线峰形重叠。NTC 的 Tm 值等于目的基因的 Tm 值。
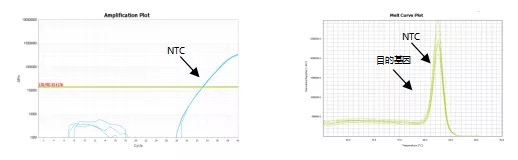
这种情况下,说明体系已被气溶胶污染了。那么,体系被污染,目的基因的 CT 值还能正常使用吗?
需要计算目的基因的 CT 值与 NTC 的 CT值的差值(△CT)来判定。
若△CT≥ 5,说明气溶胶带来的污染对体系影响非常小,可以忽略不计。
如果达不到△CT≥ 5 的程度,△CT≥ 3 也可以认为气溶胶的污染程度很低,目的基因的 CT 值可正常使用。
若△CT<3,说明污染已经很严重了,目的基因的 CT 值是不能使用的。
补充:为何可以通过 Tm 值就可以判断是引物二聚体还是气溶胶污染呢?使用相同 qPCR 试剂进行扩增时,Tm 值大小是由目的片段的产物长度与 GC 含量决定的,目的片段越长,GC 含量越高,Tm 值越大。
2、若 NTC 出现的扩增曲线是由引物二聚体造成的,其长度往往较短(一般引物二聚体的长度大约为 50 - 60bp), 低于目的片段的长度(目的片段长度一般为 80 - 200bp),所以引物二聚体的 Tm 值小于目的片段的 Tm 值,引物二聚体形成的融解曲线的峰形与目的基因的峰形不重叠。
3. CT 值很大怎么办?
造成 CT 值偏大的因素较多,主要分为以下两大类情况:
(1)相同体系,前期实验 CT 值正常,本次实验,所有基因扩增 CT 值皆偏大。
这种情况下,需要排查 RNA 是否存在降解。如何判定 RNA 是否存在降解呢?可通过 1% 的琼脂糖凝胶电泳进行检测。
完整度好的 RNA 是有三条带的,以真核生物为例,三条带分别是 28s/18s/5s,且 28s 条带的亮度是 18s 的两倍,5s 最暗(下图左)。如果 RNA 发生降解,会出现三条带的亮度发生变化,甚至不存在完整的三条带。如果 28s 几乎看不到了,整个泳道 Smear 严重,说明 RNA 的降解已经很严重了,此时 RNA 不建议用作后续的逆转录实验(下图右)。重新提取 RNA 重复实验。

①如果您的样本是组织,取样的过程非常重要。组织内部是有内源性 RNase 存在的,组织离体后内源性 RNase 则开始发挥作用,RNA 产生降解。所以离体的组织必须立马放在液氮中速冻,之后转移至 -80℃ 长期保存,且避免反复冻融。研磨组织的过程中需要保证在液氮环境中研磨。RNA 提取的过程中,保证样本的上样量不超过提取试剂盒说明书中规定的最大上样量,上样量过多,同样会造成 RNA 降解。
③除此之外,提取的过程中戴一次性干净手套;在单独洁净的区域操作;戴口罩并在操作过程中避免讲话。可有效防止实验者汗液、唾液中的 RNase 污染。
(2)该基因第一次扩增,其 CT 值偏大,而其余基因的 CT 值正常。
这种情况下就需要判定是因为基因的扩增效率低导致的 CT 值偏大,还是基因本身的表达量低造成的 CT 值偏大。
如何判定是因为基因的扩增效率低导致的 CT 值偏大,还是基因本身的表达量低造成的 CT 值偏大呢?首先需要计算引物的扩增效率。
可将基因的扩增产物进行梯度稀释(至少三个梯度,且梯度之间的 △CT 均一,防止因为操作原因导致标准曲线线性关系差,进而影响扩增效率的计算),同时进行 qPCR。将得到的标准曲线进行引物扩增效率的计算:
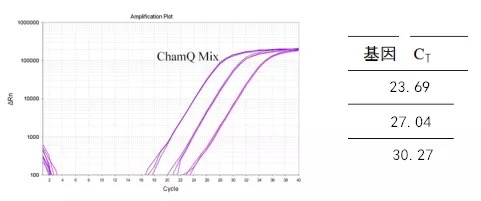
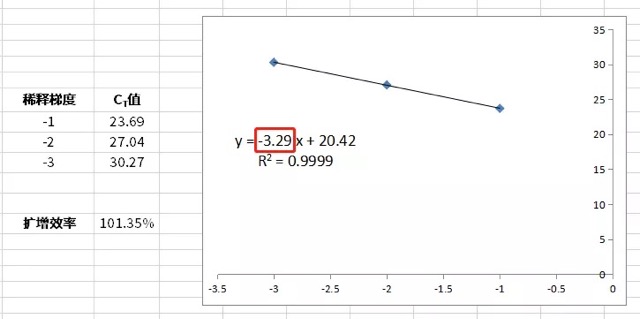
可以在 excel 上进行扩增效率的计算。稀释梯度可以设置为-1 /- 2/-3,每个梯度对应的 CT 值分别为 23.69 / 27.04 / 30.27,如下图,进行标准曲线绘制。通过标准曲线可以得到线性方程(y = -3.29 x + 20.42)与 R2 值(R2 = 0.9999)。将线性方程得到的斜率(-3.29)带入扩增效率计算公式中:

即可得到扩增效率。本基因使用 Vazyme #Q711 扩增效率为 101.35%。
只有当扩增效率满足 90 - 120%,且标准曲线 R2≥ 0.99,引物的扩增效率才是合格的,定量出来的 CT值才可以用来计算。且扩增效率越接近 100%,引物的扩增性能越优。
1、若扩增效率不满足 90 - 120%,那 CT值偏大是因为扩增效率不达标导致的,需要重新设计引物。
2、若引物的扩增效率满足 90 - 120% 前提下,CT 值仍然很大,则是基因本身表达量低造成的 CT 值偏大,可以提高模板的添加量,但最根本的方法是改为探针法进行定量。探针法的灵敏度是高于染料法的。