做好 ChIP 的四个注意事项
丁香实验
染色质免疫沉淀 (ChIP) 用于检测细胞核中天然染色质内的蛋白质与 DNA 之间的相互作用。ChIP 实验首先需要将细胞固定,即将蛋白质与 DNA 相互作用交联固定到位。
然后将染色质打断为片段,使用抗体对目的蛋白质以及与其结合的所有 DNA 进行免疫沉淀。最后,解交联,对沉淀 DNA 进行纯化。纯化的 DNA 可进行进一步的分析,如标准或实时 PCR、芯片或测序分析。
这些实验对染色质的完整性、蛋白质表位的质量以及免疫沉淀抗体的特异性非常敏感。尤其当目标蛋白质与 DNA 相互作用极少发生或不稳定时,这些变量就更为关键。
第 1 步 – 采用对照(实验严谨更可靠)
虽然使用酶消化制备染色质,可以改善 ChIP 操作规程,但合理的对照和高度特异性的抗体也同样重要。在实验操作步骤中添加阳性和阴性对照抗体可确保分析正常进行且结果可靠。
阳性对照
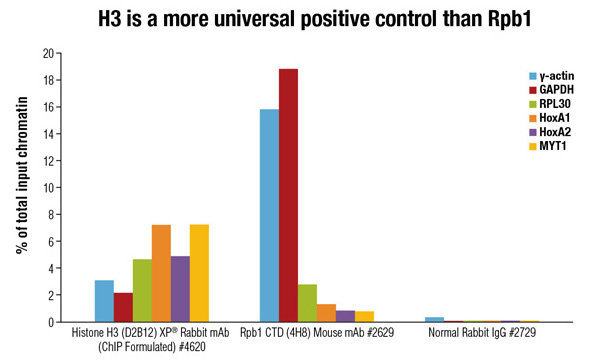
许多市售的试剂盒附带 Rpb1(RNA 聚合酶 II 的最大亚基)的抗体,做为阳性对照抗体。但是,Rpb1 仅在活性转录位点结合,因此,如果要研究的位点是非活性位点,那么 Rpb1 实际上将作为阴性对照使用。CST 推荐使用 Histone H3 (D2B12) XP® Rabbit mAb (ChIP Formulated) #4620。该抗体可检测与基因组中所有 DNA 序列结合的所有组蛋白 H3 类型(H3、H3.3、CENP-A)。因此,不管检测的位点活性状态如何,该抗体都能为 ChIP 实验提供通用的阳性对照。
阴性对照
阴性对照抗体(如正常兔 IgG)不能识别特异抗原表位,因此可用于检测非特异性结合。例如,如果阴性对照样品中的产物量等于特异靶标样品中产物量,那么可得出结论,特异靶标抗体出现非特异结合或本底水平的信号。这个结果结合阳性组蛋白 H3 信号,表明您的染色质断裂不充分且您的特异靶标抗体未发挥作用。

第 2 步:染色质制备(做好准备工作)– 即使是最好的抗体也无法 pull-down 不存在的东西
许多实验室使用超声处理来制备用于免疫沉淀的染色质。虽然效果不错,但超声处理需要将染色质暴露于容易导致蛋白变性的恶劣条件中(比如高热和去污剂),这些条件可能会同时破坏抗体抗原表位和基因组 DNA。
此外,超声处理条件稳定性较差。制备的方法和质量将视所使用超声仪的类型和品牌,以及所使用的超声仪探头的状况而变化。此外,染色质处理不足与处理过度之间可能仅有数秒差异。因此,使用该方法难以生成均一大小的染色质片段样品。
高频率、非常稳定的蛋白质与 DNA 相互作用(如组蛋白与 DNA 之间的相互作用),发生频率之高,即使操作流程并不完善也常能被检测到。如果操作规程不能确保蛋白质和 DNA 的完整性,或者使用了对靶标不具有高度特异性的抗体,则低频率且较不稳定的相互作用(比如多梳蛋白与特定基因 [例如 Ezh2] 的结合)就可能会低于检测阈值。
相比之下,酶消化方法使用微球菌核酸酶切入染色质核小体之间的连接区域,柔和地把染色质剪切成均一片段。酶消化无需高热或去污剂,且如果使用与细胞数量成比例的酶用量,还可得到一致的结果。
因此,酶消化方法更易于控制,可避免抗原表位和 DNA 被剪切或变性,且得到的一致、高品质的染色质样品还有利于免疫沉淀。
下方显示的实验分别使用 SimpleChIP® Plus Enzymatic Chromatin IP Kit (Magnetic Beads) #9005 和另一家公司的基于超声处理的试剂盒进行。首先采用酶消化(依照 SimpleChIP 试剂盒使用说明)或超声处理(依照其他公司的试剂盒使用说明)来处理染色质样品。然后,分别使用来自 SimpleChIP® 或其他公司试剂盒的免疫沉淀试剂,使染色质与指定的一组抗体进行免疫沉淀。通过实时 PCR 对免疫沉淀的 DNA 进行定量,以占总染色质 input 量的百分比来表示。
与超声处理制备的染色质相比,酶消化制备的染色质显示靶标 DNA 位点的富集度更高,不管使用的是另一家公司的免疫沉淀试剂盒还是 SimpleChIP® 试剂盒,结果均是如此。在分析稳定性较低的相互作用,比如 polycomb 蛋白(Ezh2 [D] 或 SUZ12 [E])与特定基因的结合时,这一点尤其明显。

第 3 步 - 选择抗体
非高度特异的靶标抗体可能会出现不可预见的结合并增加背景信号,从而增加检测低丰度或低稳定性相互作用的难度。
您的抗体应该满足以下标准:
靶标特异性:
- 抗体应与阳性/阴性对照细胞系、敲除细胞或经过 siRNA 处理的细胞中预期表达一致。
- 抗体应检测酶类特异活化剂和/或抑制剂处理后有相应表达。
- 应使用肽阵列或肽 ELISA 来验证修饰特异组蛋白抗体的特异性。
可接受的信噪比:
- 应使用同型对照评估信噪比。
- 如实时 PCR 分析所示,已知靶标基因的富集度应至少达到 10 倍本底水平以上。
抗体的质量不是决定免疫沉淀结果的唯一因素;抗体的浓度也会对结果造成重大影响。如果抗体浓度相对染色质的量过高,其可能会使分析过度饱和,导致特异信号降低和/或背景增加。相反,如果抗体的浓度过低,则不能与 IP 样品中的所有靶标蛋白质完全结合,导致免疫沉淀效率降低。

CST 提供的 ChIP 级抗体均根据上述标准进行检测,每个抗体都有推荐的开始浓度。但是,如果您所用抗体来自其他供应商,本指南也可帮助您确保抗体按照您所预期的方式发挥作用。
第 4 步 – 下游分析
DNA 经过免疫沉淀处理后,即可进行纯化,以便进行后续结果分析。有若干种方法可用于分析与特定蛋白质靶标一起免疫沉淀的纯化 DNA。我们将在下文描述两种最常使用的方法。
实时 PCR
可使用标准或实时定量 PCR 方法对纯化 DNA 进行分析。免疫富集的纯化 DNA 的 PCR 分析,可帮助用户在不同生物条件下分析特定的特异蛋白质-基因相互作用。这些实验需要使用特定区域具有目的引物,因此富集数据局限于被扩增的小片段的基因位点。
可使用实时 PCR 仪器附带的软件对 PCR 结果进行分析。或者,可使用以下所示的公式手动计算 IP 效率,该公式显示信号为占总染色质 input 量的百分比。

二代测序分析 (NGS)
二代测序分析 (NGS) 可用来在 ChIP 之后使用操作流程中所述的 ChIP 测序对免疫沉淀的 DNA 进行分析。ChIP 测序分析为用户提供蛋白质/DNA 相互作用的高分辨率基因组范围内的视图,这是实时 PCR 分析无法实现的。
例如,在以下实验中,使用活性组蛋白标记物 H3K4me3、非活性组蛋白标记 H3K27me3 和 polycomb 家族转录因子 Ezh2(多结合在 H3K27me3 标记的基因区段)的抗体分别进行 IP。已知 Ezh2 与 HoxA 基因簇结合,但不与 GAPDH 基因结合,通过实时 PCR 和下一代测序分析如下所示。(I)
重要的是,实时 PCR 方法仅可对预先选择的基因组位点进行检测,而 NGS 可让研究者获得基因组上 H3K4me3 和 H3K27me3 标记物和 Ezh2 结合位点的概况。使用该方法获得的信息量很大,ChIP 测序分析因此成为一种适合研究正常发育过程中或病理状态下发生的表观遗传变化的强大工具。