干货:小分子量蛋白(11KD)WB实验艰辛历程及经验总结
丁香园论坛
个人工作多年以后再回来读博的,所以实验技术什么的从头学起,这其中WB走的弯路最多,现在就和大家聊聊我个人的历程,并交流一下自己的经验。这个经验是我跑一个11KD分子量分泌性蛋白得出的,肯定不会适用于所有情况,但是论坛里面受困于小分子量蛋白WB的朋友还是很多,所以聊胜于无,在此分享一下。
我搞得蛋白质是一个11KD的分泌性蛋白,并且是我实验设计中一个重要的指标,最初学习WB技术,受困于二抗不合格一直连内参都做不出来。。。后面改换抗体之后,才相对顺利一点,其他指标也相继出来了。所以抗体真的很重要。
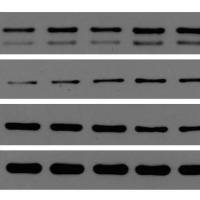
但是在做WB实验的7、8个月过程中,我的核心的一个蛋白一直处于混沌状态,可能跑30次能现身一次,现身之后又没影好几个月,就这样捉摸不定,搞得我很烦,但又无可奈何。询问了实验室的同学们,说法各一:1、有人说小分子量蛋白就是难跑,为什么难大家也说不清楚。2、有的说分泌性蛋白本身胞内含量少,不好跑,需要加大上样量,似乎也是实话。3、还有的说小分子量蛋白容易降解,你的蛋白质降解了吧,我姑且信了。但是95%的时候我跑出的条带都是大白板,纵然我通过PCR、细胞的免疫荧光都能够发现这个蛋白,但是就是WB做不出来,4、也有朋友告诉我说分泌型蛋白你还是做ELISA吧,可是一来这个蛋白的ELISA试剂盒好贵的,二来我就是想做WB。所以就开始了上下求索之路。95%的时间跑出来的条带是这样的。。。
这一求索就是几个月的时间。期间一直觉得电泳没什么技术含量,电转的过程才是重点,于是纠结于电转条件;也纠结过电转液的配置等。就在最近,再次翻阅论坛里面大神的回帖,其中一个大神提到:小分子量蛋白容易在电泳过程中弥散,电泳在压缩胶里多压一会,在分离胶里面跑一半就好了。对这个话百思不得其解,于是开始查询一些实验技术方面的文献,其中有几篇文献对我很有启发,其中有些技术原理方面的内容如下:
在含SDS缓冲液的样品中,小分子多肽的浓缩是较困难的,因为小分子多肽与SDS形成的复合体具有与SDS本身类似的电荷和大小,所以偏离了相对迁移率和分子质量对数的相互关系,因此浓缩对于小分子多肽的SDS-PAGE来说就成了一个突出问题。
于是回去翻了翻自己曾经偶然跑出来的条带的模样,给我的感觉就是压缩的不好,然后还有弥散的现象(就是那种蛋白晕开的模样,例如这条带下面的波浪边缘,当然也可能是胶不均匀的原因吧,反正我当时就觉得是弥散的现象)

然后我就突然有种恍然大悟的感觉,也许说的不对,但是我个人的感觉是:一般较大的分子量的蛋白(如20-70KD)与上样缓冲液中的SDS结合后,因为本身蛋白分子大,SDS附着在上面之后,还是和胶里面的SDS成分有较大差异的,那么在一定电流方向的作用下,就能够顺着电流方向向下电泳;而小分子蛋白被SDS包裹结合形成复合物后,因为蛋白分子小,包裹上SDS后就和胶里面本身的SDS差别没那么大了,那么此时就算有电流作用,它也不会那么听话的顺流而下,毕竟和周遭的胶里面的SDS区别不大,在电泳向下走的过程中,可能向其他方向混乱的运动,走着走着就晕染开了,就像墨点到宣纸上一样。所以回到前面大神说的话,让多压一会,那么就是为了让小分子蛋白尽量聚集;少电泳一会,就是稍微跑开marker之后,能够分开小分子蛋白和内参即可,加入跑多了,例如溴酚蓝跑到下沿1cm以上的位置,那时候可能小分子蛋白就又晕染开消失在胶里面了,这样的话一抗也就不能识别那么弥散的蛋白了。专业人士原谅我粗浅的认识哈,也许不对,但是我理解的就是这样,我就是打个比方让其他的科研小白能理解。
然后在论坛里面还看到一个建议就是用0.2%的戊二醛固定转膜完成后的条带45分钟,然后再进行后续封闭漂洗等步骤,为的就是防止小分子蛋白在后续操作中洗脱了。于是乎说干就干,开始了我的再次改进的实验历程,说来简单,实际上从25号到1号,一共8天时间,我大概做了12次WB,终于能够重复出来结果了。要点如下:
1、电转液中一定不要加SDS。对于大分子量蛋白加入SDS是为了增加转膜效率,道理上是增加了蛋白表面电荷。而对于小分子量蛋白,SDS千万不能加,否则会封闭小分子蛋白的抗原位点(我忘记从哪里看到的了,文献不能在这里给出,大家勿吐槽我哈)
2、从最开始纠结于电转过程,使劲摸索电转条件,现在发现电泳过程同样很重要啊。电转的时候其实只要预染marker只要转到膜上了,那么你的相应分子量的目的蛋白也就转过去了,所以这就是你摸索条件的指示带。
3、电泳过程中有推荐TRICINE-SDS-PAGE胶来进行电泳,会更有利于小分子量蛋白的分离,研读了一些文献,这个效果应该还是很肯定的,但是鄙人没有做过这种电泳,所以给不了什么经验,我最终还是用普通SDS-PAGE胶做出来的,不过鉴于我的蛋白分子量是11KD,那么假如你是几KD甚至更小分子量的多肽,那么还是建议你用TRICINE-SDS-PAGE胶来电泳吧。
4、在我用SDS-PAGE胶进行电泳过程中,一直以来都是按照说明书配制压缩胶和分离胶的,并且在说明书中,以配置2块胶为例,分离胶说明书中是让配置10ml,压缩胶是3ml。我一直以为是对应关系,在这次大悟之后我发现分离和压缩完全不是一对一对应关系,人家只是给了你配置这么多体积胶的配方而已,虽然在一个纵列上,但是绝不是对应关系(我确实才觉悟,高手轻鄙视哈)。
5、接上一条经验,所以我在配胶过程中,下层分离胶配制了10ml,但是实际上每块玻板里面只加了大概3.5ml吧,也就是整个玻板高度的60-70%的样子。然后压缩胶配了6ml,玻板填满插梳子,等凝固。这里我就是想让我的小分子蛋白尽量在浓缩胶里面多浓缩、压扁,这样后续再分离胶里面,即使弥散一些,也总还有剩下的。
6、电泳开始,在浓缩胶层里面跑的时候,我是60-70V电压,跑了大概快一个小时,反正就是溴酚蓝都集中在上下层胶的那个界面的位置,并且在界面那里好半天都不动了,那么这个过程我理解就是小分子量蛋白虽然表面电荷和胶里面的SDS相当,但是终究还是会沿着电流方向定向移动的,所以就多压一会吧。然后开始调整电压为110-120V在分离胶里面跑,我是跑到分离胶一半的位置就停止电泳了,这时候marker已经分开一些了。
7、接上一条,marker分开了一些,但是实话说分的并不好,你如果想同时测好几个蛋白指标是很困难的,不好切胶,也不好敷条带,所以我的建议,小分子蛋白就单独出来跑吧。
8、电泳完成后,开始电转,电转过程我试过90V恒压60分钟,也试过250ma恒流15分钟,对于我的蛋白都能得到满意结果。
9、转膜后条带是否必须戊二醛固定?经过我的尝试,对于我的11KD蛋白来说固定不固定没有影响,那么即使固定了,戊二醛也不会影响后续的抗原抗体反应。所以各位同学们固定不固定随意吧,假如你的蛋白分子量很小,也许5KD以下?那么固定一下也未尝不可。
10、抗原抗体反应很灵敏,我的抗体在免疫荧光上面已经验证过的,所以敷抗体的过程没什么说的。不过抗体稀释比例的话,我是习惯提高浓度的,说明书1:1000,我就1:500。这个没有依据,纯癖好,也是师兄们教的。。。
11、显影这一步我觉得也有可说的。我试过多次,发现我的这个蛋白第一遍滴加显影液后条带不会很清晰,然后你可以把条带拿出来就放一边让它反应一会,然后再放回机器里面,重新滴加显影液显影,效果就会好不少。还有显影时间,结合我的示例,机器给出的自动曝光时间是30几秒,我就直接加1分钟改为1分30几秒,然后就得到了下面的条带
第一遍显影条带,可以看到模糊有东西,但是不清楚,于是我拿出来放一边反应一下。
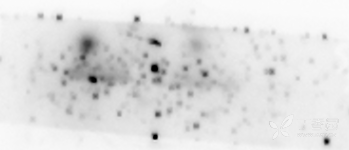
反应几分钟后,我再把条带放进机器,时间上直接增加1分钟,再滴加新的显影液,是不是好了很多

到这里我就总结完了我的经验和教训。当然这78个月的摸索,还有很多想说的,但是限于篇幅和叙事能力有限,就大致总结了几条,有些啰嗦,见谅。希望对还被小分子量蛋白WB折磨的朋友们有帮助。
问①
谢谢楼主的经验,学习了不少新知识。楼主把分泌蛋白的WB做得这么漂亮,好了不起。但我有一些问题请教楼主
1)膜。楼主用的是PVDF膜还是NC膜?0.22um还是0.45um?
2)转膜时间。不知道楼主的转膜液配方。我们实验室为:
甘氨酸14.4g,Tris3.03g,双蒸水定容至800ml,加 入200ml甲醇。
这个配方的转膜液,转膜时,使用的电泳仪为伯乐的。恒流250mA时对应的电压为90V左右。
楼主90v转60min,250mA转15min,转移效率是一致的吗?我试过恒流250mA转20min,但感觉Maker 没有怎么转过去。
3)显影,楼主用的什么牌子的显影液?
答①
1、膜是PVDF,用的0.22孔径的膜,小分子还是选择小孔径放心点
2、转膜液配方差不多,我是用的乙醇。个人感觉转膜效率差不多,不过现在为了转膜省时间我都是恒流进行了,250毫安,15-20分钟的样子,marker很清晰的过去了
3、显影液用过millipore的,不过后面都是用的万类的显影液,很便宜,280块
问②
楼主楼主楼主,我的蛋白量14和16基本上16每次都能跑出来,但是14就跑出过来一次,我这几次用的15%的分离胶。这两次跑出来的蛋白特别宽,特别宽,如图(就看最左边两条带),为什么呀?你都是用多少浓度的分离胶?谢谢楼主!!!
答②
我是12%的分离胶。你可以压缩胶多配点,大概到玻板1/3的位置,然后分离胶配到玻板2/3的样子,然后电泳的时候电泳液用新配的(我个人体会,新配的电泳液,对于蛋白条带的压缩效果会更好,也许新配的里面电荷什么更适合吧,另外我只在两块玻板中间的小槽子里面加入新配的电泳液,外面的大槽子还是用了2-3次的电泳液,这样就可以得到不错的压缩效果和条带外观)。我跑这样的小分子都是单独一次跑的,即转膜时候只在内参和目的条带位置敷膜,所以电泳到分离胶一半稍多点的位置,marker分开的差不多了,方便你在内参和目的条带位置敷膜了即可。
问③
非常感谢楼主的经验分享。
我在跑12KD左右的蛋白,半个月只跑出来一次,而且效果不怎么好。
打算明天用你的方法验证一下,届时回来反馈。
还有就是顺便问一下,全部使用新配置电解液和两版之间使用新电解液外围使用旧电解液效果有差别么?
浓缩胶和分离胶体积1:1会不会比1:2效果更好呢?
答③
我个人尝试后感觉,只要两个玻璃板之间的空间用新电泳液就ok了,效果没什么区别。
至于浓缩和分离的体积改为1:1,我觉得当然可以,不过那样的话浓缩胶电泳的时间怕是会更长,我1:2配比的时候,有时候浓缩胶都要70V跑50分钟,你要是1;1的花可能得1个多小时了。。。。还有后续的分离胶距离又很短,也许marker跑的分不开,到时候你切胶不方便,敷PVDF膜也不方便
感谢站友:windkiller1984
关键词:实验专区