简介
研究背景:
植物细胞表面具有碳水化合物信号分子,因此能够与环境中的微生物发生联系。在这里,我们从两个赖氨酸基序受体外结构域的晶体结构中确定了LCO感知的结构基础,并在LCO识别和共生功能所必需的结合位点中鉴定了一个疏水斑块。两者一起引发植物中共生通路;本研究中使用层析技术,分别利用HisTrap excel和HisTrap HP捕获并富集目标蛋白,之后根据样品量的不同分别选用不同的凝胶过滤层析柱,去除聚集体及分子量具备差异的杂质,将获得的蛋白进行结构生物学及生物化学分析,结果证明NFP/NFR5细菌脂质几丁寡糖受体依据控制受体激活和信号特征的动能校对机制来区分细菌的共生体结构。研究证明了LCO结合位点可用于支持共生功能,大大促进了未来豆科植物和非豆科植物中受体的改造的机会。
原理
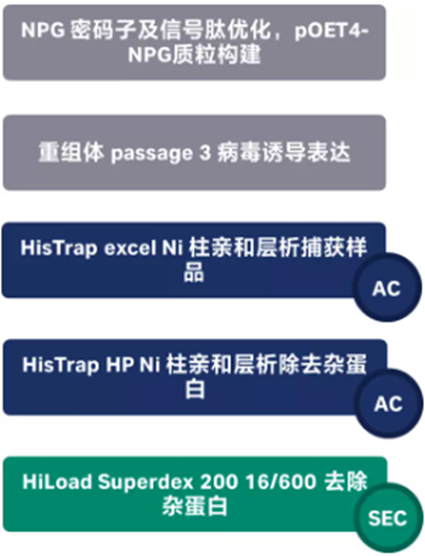
图5 重组标签蛋白纯化流程图
材料与仪器
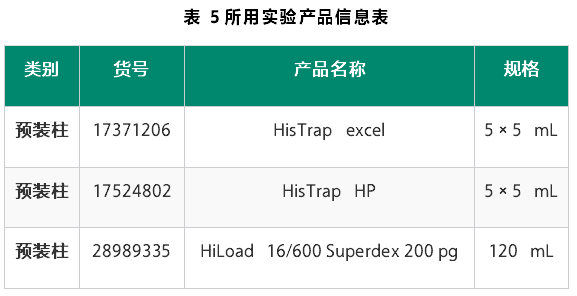
步骤
实验方法:
优化蒺藜状苜蓿NFP基因的密码子,并用AcMNPV gp67信号肽代替天然的NFP信号肽(1-27),将6个组氨酸组成的His标签添加到C端,将设计好的分子克隆至pOET4杆状病毒载体上并转染至Sf9细胞中用于后续的诱导表达。成功表达目标蛋白后,离心收取分泌到培养基中的NFP蛋白,将蛋白4℃过夜透析至50 mM Tris-HCl pH 8,200 mM NaCl中。用于后续的纯化。
首先,使用HisTrap excel层析柱捕获分泌蛋白,进行初步富集,之后采用HisTrap HP高分辨率镍柱对样品进行精细分离,捕获获得含有His标签的蛋白组分。
然后,根据蛋白量的需求,采用Superdex 200 increase 10/300, Superose 6 10/300 GL或HiLoad Superdex 200 16/600进行精纯,去除蛋白聚集体及分子量具备差异的分子。
结果图谱显示获得的组分为单一蛋白分子,SDS-PAGE证明获得的蛋白纯度较高,可应用于后续结构生物学实验。结晶实验进一步证明了NFP胞外区28-246呈现三叶草形结构,发现NFP与其他的带有参与LCO和几丁质引发的防御信号的激活激酶LysM受体共有半胱氨酸桥连接模式和整体的折叠。为揭示豆科植物与不同细菌共生的机制奠定基础。
Reference:
Gysel K et al. Kinetic proofreading of lipochitooligosaccharides determines signal activation of symbiotic plant receptors. Proc Natl Acad Sci U S A. 2021 Nov 2;118(44):e2111031118.
来源:丁香实验