简介
研究背景:
封装体是自组装的蛋白质纳米亚结构,能够有选择性地封装特定的载体蛋白,包括参与铁储存、硫代谢和抗压应激的酶。它们代表了许多病原体采用的独特分区策略,以促进特定的代谢能力。封装由特定的载体蛋白结构域TP(Target peptides)介导,但目前对最大封装体载体类别——染料脱色过氧化物酶(DyPs)的封装结构基础尚不清楚。作者对来自肠道致病菌克雷伯氏肺炎菌的含DyP的封装体进行了表征,使用了凝胶过滤层析与阴离子交换层析两种层析方法,最终通过结合冷冻电子显微镜和TP以及TP结合位点突变,阐明了载体封装的分子基础。该文章表明了,TP结合通过合作的疏水和离子相互作用以及形状互补来介导。这一结果拓展了对蛋白质纳米亚结构内酶封装的分子理解,并为合理调节封装体载体装载以用于生物医学和生物技术应用奠定了基础。
原理
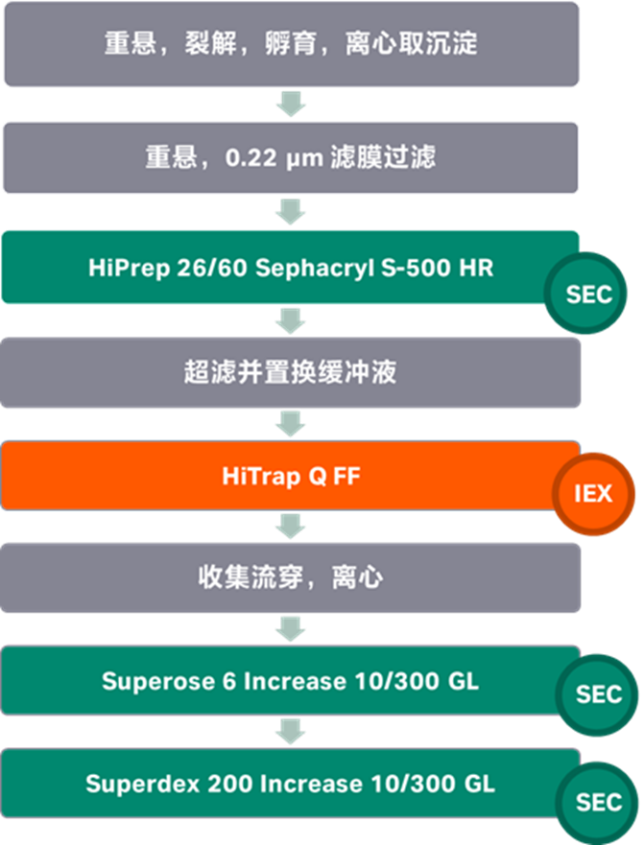
图4 蛋白质冷冻细菌沉淀纯化流程图
材料与仪器
步骤
实验方法:
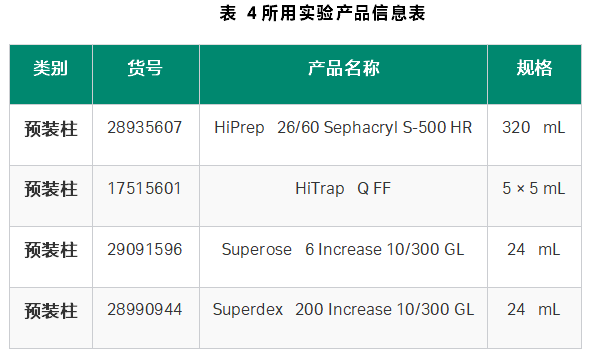
将蛋白质冷冻细菌沉淀在冰上融化,并在冷的Tris 缓冲盐溶液中(20 mM Tris pH 7.5,150 mM NaCl)中重新悬浮(5 mL/g 湿细胞质量)。加入裂解组分0.5 mg/mL溶菌酶,1 mM三(2-羧乙基)磷酸三钠TCEP,每100 mL一片SIGMAFAST无EDTA蛋白酶抑制剂混合片,0.5 mM MgCl2,和25单位/mL 苯甲酸酶核酸酶)并在冰上裂解10分钟。然后在60%振幅下超声5分钟(每次8秒,停16秒),直到不再黏稠。超声后,样品在4°C离心8000rcf 15分钟。样品随后经历了10% 聚乙二醇(PEG)8000沉淀(裂解液加入至10% PEG 8K和500 mM NaCl,冰上孵育30分钟,然后在8000 rcf 离心15分钟)。上清液被丢弃,沉淀物用5 mL TBS pH 7.5重新悬浮,并通过0.22 μm注射器滤膜过滤。然后将蛋白样品通过Sephacryl S-500 纯化。样品组分被汇集,并使用离心过滤单元(30 kDa分子量截止)进行缓冲液交换至AIEX缓冲液(20 mM Tris pH 7.5),然后通过线性梯度进入AIEX 缓冲液和1 M NaCl 的HiTrap Q-FF 纯化。收集样品流穿液,并以10000 rcf 离心10分钟,然后将其加载通过预先平衡的TBS pH 7.5的Superose 6 10/300 GL 柱进行最终纯化。
后续对纯化样品的分析中显示了两个主要的洗脱峰,一个在16 mL处,与KpDyP六聚体(约244 kDa)一致,另一个在18 mL处,可能代表较低级别的KpDyP多聚体或单体。将纯化后的KpDyP上样至 Superdex 200 Increase 10/300 GL柱进行组分分离,并将收集的组分进行原生PAGE分析,进一步证实了多种多聚态的存在,包括六聚体、二聚体和单体。
Reference:
Jones, J.A. Andreas, M.P. & Giessen, T.W. Structural basis for peroxidase encapsulation inside the encapsulin from the Gram-negative pathogen Klebsiella pneumoniae. Nat Commun 15, 2558 (2024). https://doi.org/10.1038/s41467-024-46880-x.
内容来源:Cytiva
来源:丁香实验