简介
AAV 介绍
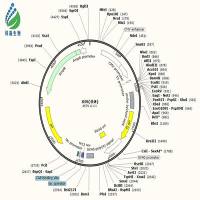
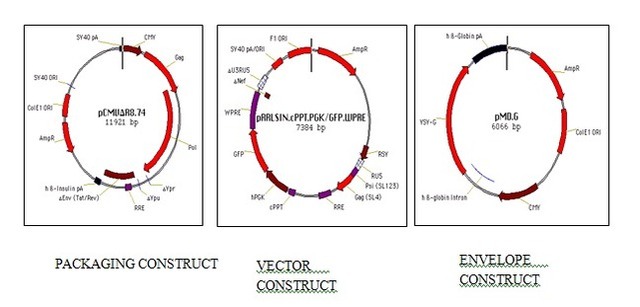
腺相关病毒(AAV)属微小病毒科(parvovirus),为无包膜的单链线状 DNA 病毒。只有在腺病毒或者疱疹病毒等辅助病毒协助下,宿主才能产生具有感染性的 AAV,所以 AAV 被称作腺相关病毒。典型的 AAV2 基因组约 4800bp,包括 2 个反向末端重复序列(ITR,145 bp)和两个读码框(ORF)-Rep 和 Cap(图 1)。ITR 对合成互补 DNA 链是必需的;Rep 和 Cap 可以翻译成多种不同蛋白,如 AAV 生活周期必需的 Rep78、Rep68、Rep52 和 Rep40 以及包膜蛋白 VP1、VP2 及 VP3 等。AAV 病毒系统就是用目的基因替换掉 Rep 和 Cap,然后与表达 Rep 和 Cap 基因的质粒共转,从而产生包含目的基因的 AAV。目前 AAV 有 12 种血清型、100 多种变体。不同的血清型对组织或器官有着不同的亲和性。由于安全性高、免疫原性小、表达周期久等优点,AAV 被称为目前最适合在体(in vivo)研究基因功能的利器。
图 1、 AAV2 基因组结构示意图
原理
整体包装流程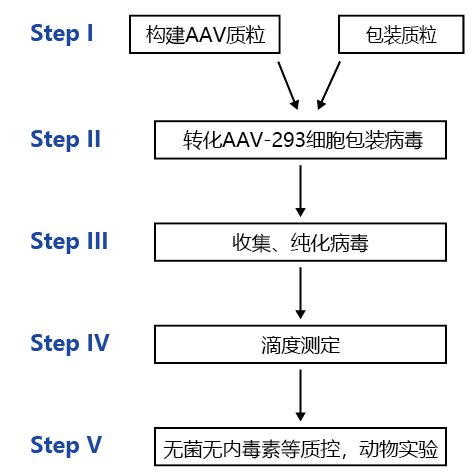
图 2、 AAV 包装实验流程图
材料与仪器
步骤
1. 载体构建
AAV 包装之前需要构建表达目的基因的载体 pHBAAV-xxx。可以自由选择启动子、荧光标记、是否需要 Cre 依赖等特点进行定制。质粒构建完成后需要转化后再使用去内毒素质粒试剂盒抽提,要求浓度不低于 1μg/μl,A260/280 在 1.7~1.8。
2. AAV 包装
事先准备好用于包装病毒的 AAV-293 细胞(50-70% 的汇合度,无支原体污染)和病毒质粒,转染一个 10 cm培养皿,成分如下:
表1、AAV 包装过程中转染一个标准 10 cm dish 所需要质粒和转染试剂用量
DMEM 需在 37℃ 水浴中预热,LipoFiterTM 转染试剂建议恢复至室温后使用,使用前需摇匀。转染后 6h 换新鲜培液。
3.AAV 收集和纯化
转染后 72h,收集所有的细胞用液氮反复冻融三次收集上清液,然后使用 Benonase 酶消化,所得上清用 Biomiga 品牌纯化柱纯化,所得病毒分装后于 -80°C 保存。AAV 滴度测定采用的国际标准-对 ITR 或者 WPRE 元件采取绝对 qPCR 定量法。
注意事项
- AAV 相关实验请在生物安全柜(BL-2 级别)内操作。
- 操作病毒时请穿实验服,佩戴口罩和手套,尽量不要裸露双手及手臂的皮肤。
- 操作病毒时特别小心病毒溅出。如果操作时超净工作台有病毒污染,请立即用 70% 乙醇加 1% 的 SDS 溶液擦拭干净。接触过病毒的枪头、离心管、培养板、培养液请用 84 消毒液浸泡后统一处理。
- 如需要离心,应使用密封性好的离心管,如有必要请用封口膜封口后离心。
- 动物注射操作请在生物安全柜内(BL-2 级别)完成。
- 病毒相关的废弃物需要特殊收集,统一经高温灭菌处理。
- 实验完毕用洗手液清洗双手。
常见问题
Q1、腺相关病毒是什么?和实验室⽤的 AAV 载体的区别在哪⾥?
A:腺相关病毒,即 Adeno-Associated Virus (AAV), 是⾃然界中存在的天然病毒,基因组上有 rep 基因和 cap 基因,因此也叫野⽣型腺相关病毒,即 wide type AAV(wtAAV);实验室⽤的 AAV 载体,是在腺相关病毒的基础上经过⼈⼯改造的质粒,基因组上没有 rep 和 cap 基因,在两个 ITR 之间是外源启动子和需要启动表达的目的序列,rep 和 cap 基因由另外的质粒(rc 质粒)表达,因为 cap 基因决定着向相关病毒的血清型,因此 rc 质粒也被称为血清型质粒,实验室包装的腺相关病毒也被称为重组腺相关病毒,即 recombinant AAV(rAAV)。
Q2、不同的 AAV 血清型主要区别是什么?
几乎所有的 AAV 病毒骨架都是来源 AAV2 型的。AAV 不同血清型的差异在于包裹 AAV 遗传物质的蛋白质外壳(Capsid),比如 AAV5 型、AAV8 型和 AAV9 型等,也可以分别标记为 AAV2/5,AAV2/8 和 AAV2/9,其中 2 代表骨架来源于 AAV2,血清型为 5,8 和 9。
Q3、AAV 病毒载体对目的基因的大小是否有要求?
A:AAV 基因组大小为 4.7kb 左右,由于载体中固有的启动⼦序列、PolyA 序列以及两个 ITR 序列,这三个元件的序列总和在 1200bp 左右,同时可能还带有荧光标记或者抗性标记序列。所以 AAV 载体携带⽬的基因的时候,⽬的基因的长度建议不超过 2kb。目的基因由特异性启动子启动的时,外源插入序列的长度根据启动序列长度而变化,启动子序列较长时可插入的外源序列长度较小,而启动子序列较短时可插入更长的外源序列。
Q4、包毒时转染效率很低,怎么办?
A:AAV 转染的时候,需要保证细胞⽣长状态良好、合适的细胞密度和优化过的感染条件。推荐使用 lipofiter 进行转染,并在包毒前优化转染体系。
Q5、做病毒包装实验时,有时候做出来的病毒滴度很低,甚至不出毒,稳定性很差,为什么?
A:病毒包装涉及多个操作步骤,有⼏个⽅⾯需要注意:
- 不使⽤来源不清的质粒,使⽤成熟稳定的商业化载体系统;
- 细胞培养和细胞转染时,需注意细胞密度是否适中和出毒期间细胞的活⼒;
- 按操作说明进⾏转染,注意排查质粒抽提纯化的异常情况以及⽬的基因的⼤⼩、序列和蛋⽩功能等情况是否对病毒包装产⽣影响。
Q6、用于动物体内实验的 AAV 病毒,是否需要纯化与浓缩?
A:很有必要,AAV 病毒的纯化和浓缩是病毒包装中的必需步骤。细胞裂解液中含有⼤量的病毒⾐壳蛋⽩、宿主细胞碎⽚、⾎清和细胞毒素等多种成分,这些杂质如果直接被注⼊动物体内,会导致宿主强烈的免疫反应。如果病毒滴度太低,达不到感染特定靶器官组织的⽬的。因此 AAV 载体经过纯化和浓缩之后,有利于后续动物体内实验顺利进⾏。
来源:丁香实验