材料与仪器
步骤
腺相关病毒滴度检测采用实时荧光定量 PCR 法:
滴度单位:vg/mL,指每毫升中含有的病毒基因组拷贝数
1、检测步骤
- 稀释标准品质粒,设置标准品的拷贝梯度为 105 、106 、107 、108 、109 、1010。
- 配置 QPCR 反应体系,每个样品和标准品设计 3 个复孔,进行 QPCR 反应。
2、 数据分析(以 HBAAV2/9 -GFP 滴度测度为例)
- 原始实验数据。Roche LC96 实时荧光定量 PCR 仪所测 Ct 值数据如下:
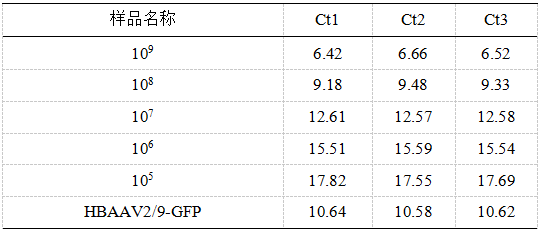
- 标准曲线制作。以每组 AAV 标准品的Ct均值为纵坐标 Y,其对应的拷贝数的对数为横坐标 X,做标准曲线,得出标准曲线的函数公式及R平方值。
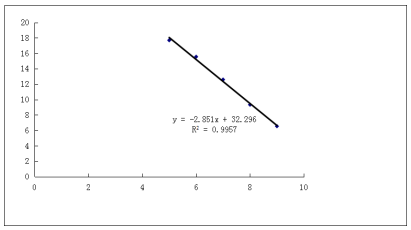
- 待测样品滴度计算。将待测 AAV 样品 Ct 均值,代入第2点所得公式,计算所加入 AAV 模板拷贝数 X,再换算成滴度。换算公式为:AAV 病毒滴度= 10x×400000(稀释倍数)vg/mL
对照病毒 HBAAV2/9-GFP 滴度 =1.6×10^12 vg/mL
常见问题
Q:不同滴度测定方法有什么有优缺点?
A: pfu 比较经典,但重复性不好,且检测时间周期长;efu 简单耗时短,但需要穿梭质粒带荧光;TCID50 可准确测定具有感染力的病毒滴度,检测周期适中;VI 只能用于纯化后的病毒,检测颗粒数而不是活性病毒滴度。
Q:标准品的标准曲线公式中 R2 有什么作用?
A:R2 代表相关系数,一般机器默认的是 R2>0.99,这样才具有可行度和线性关系
Q:保存过久的病毒需要重新检测滴度吗?
A: 若在短期内使用,可将病毒放置于 4℃ 保存,应尽快使用;如需长期保存则应放置于 -80℃,如超过六个月,建议在使用前重新测定病毒滴度。
Q:腺相关病毒为什么不常使用 PFU、TCID50 等方式检测滴度?
A: AAV 感染不会导致细胞病变效应,因此,空斑实验不能用于确定其感染滴度,而 TCID50 法一般需要利用腺病毒作为辅助病毒,另一方面,常用的活性颗粒检测方法需要在细胞中检测,AAV 基因的表达需要较长时间,检测效率低。基因组滴度以 AAV 衣壳中所含基因组含量作为定量依据,测定的是含目标基因组的 AAV 浓度,方法简单高效。
来源:丁香实验