合作专家 | 张荣钊博士
病原生物学 福建医科大学
审核专家 | 王淼博士
病原微生物 中国农业科学院
原理
限制性内切酶能够识别并酶切双链 DNA 分子中的特定核苷酸序列,使目的 DNA 片段和载体产生不平齐的粘性末端,然后在 DNA 连接酶的作用下,将酶切后的目的 DNA 片段和载体进行连接,构成重组载体。
用途
构建质粒。
材料与仪器
步骤
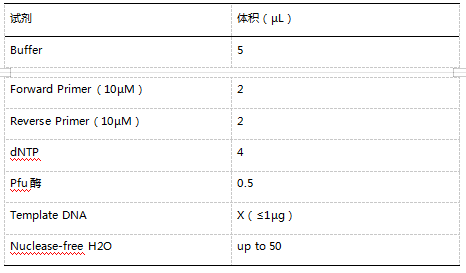
(1)PCR:按照 PCR 试剂说明书(天根 KT211),加入目的 DNA 或者 cDNA、引物、PCR 试剂、ddH2O 等,按照程序进行 PCR 扩增。参考体系如下:
程序如下:

扩增完成后,将 PCR 产物按 120 V 30 min 的条件进行琼脂糖凝胶电泳,一般情况下琼脂糖凝胶的浓度为 0.8%~1.0%。在核酸凝胶成像仪中观察目的条带,将目的凝胶切割下来,按照 DNA 琼脂糖凝胶回收试剂盒进行回收,获得目的 DNA 片段。
(2)酶切:按照限制性内切酶说明书(Thermo Scientific),将目的 DNA 片段和载体质粒进行酶切,通常 1~2 μg 质粒在 37 ℃ 酶切 2.5~3 h 足够,将酶切后的目的 DNA 片段和载体进行琼脂糖凝胶电泳和回收。
(3)连接:按照 T4 DNA 连接酶(Takara 2011A)说明书进行连接,目的 DNA 片段与载体的摩尔比建议为 3:1 - 6:1,总质量控制在 100~200 ng,4 ℃ 连接过夜或者 16 ℃ 2~3 h。

(4)质粒转化:从 -80 ℃ 冰箱取出感受态细胞(大肠杆菌,如 DH5α)置于冰上融化,加入连接产物轻轻混匀后放置冰上 30 min,42 ℃ 热激 45 s 后再放置于冰上静置 3 min。
在超净工作台中加入无抗 LB 肉汤培养基 500 μL,轻轻混匀放置于 37 ℃ 摇床中 200 rpm 震荡培养 1 h 后,5000 rpm 离心 5 min 收菌,留约 100 μL 上清轻轻吹打混匀,均匀涂布接种于含抗生素的固体 LB 平板中,置于 37 ℃ 培养箱中正放 5 min 使液体被吸收。
然后再倒置固体 LB 平板,继续在 37 ℃ 培养箱中培养 12~16 h 左右可出现单个菌落。
(5)质粒提取:挑取单个菌落于 1.5 mL EP 管中,振荡培养 1~2 h 后取一微升作为模板,进行菌液 PCR 验证,观察是否出现目的条带,进一步将上述验证正确的菌液,加入 5~20 mL 含抗生素的 LB 肉汤培养基,37 ℃ 摇床培养过夜(12~16 h),按照质粒抽提试剂盒进行提取,可以再次酶切或者测序验证。
注意事项
(1)若 PCR 产物不立即回收,应取出放在 4 ℃ 保存(短时间),或者也可琼糖凝胶电泳后切下目的片段条带,贮存于 -20 ℃(可放置时间较长),一般不建议 PCR 产物放置过久,最好直接电泳和回收。
(2)酶切时体系中的酶的用量原则是酶的总量不能超过体系的 1/10,一般在 37 ℃ 酶切 3 h 便足够。
双酶切的时候要注意同尾酶的情况,如 SalⅠ与 XhoⅠ,Bgl Ⅱ 与 BamHⅠ互为同尾酶,能产生相同的粘性末端;载体单酶切是通常要考虑载体的自连,因此连接前可以经过小牛肠碱性磷酸酶(CIP)去磷酸化处理。
常见问题
阳性克隆少。可能载体酶切不够充分,或者质粒转化感受态的效率低。可以用酶切后未连接的载体作为阴性对照,质粒作为阳性对照进行转化。
来源:丁香实验







