原理
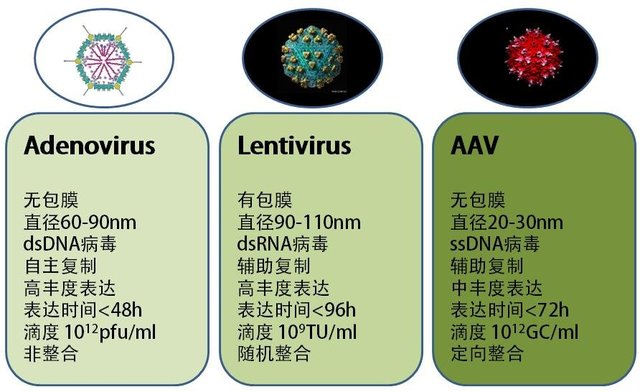
腺相关病毒(adeno-associated virus,AAV)是一类细小病毒,基因组为单链 DNA,对分裂细胞和非分裂细胞均具有感染能力。通常需要腺病毒或疱疹病毒帮助其在体内复制扩增。重组腺相关病毒(recombinant AAV,rAAV)是利用 AAV2 型基因组与不同血清型的衣壳蛋白基因组结合产生的混合体病毒载体,可将外源基因高效递送至生物体。
用途
AAV 感染细胞表达外源基因。
材料与仪器
步骤
1.准备目的细胞
(1) 从液氮罐中取出细胞冻存管,迅速放入 37 ℃ 水浴中,并不时摇动使其尽快解冻。
(2) 完全解冻后,1300 rpm,离心 3 min,75% 酒精擦拭冻存管消毒后,移至生物安全柜。
(3) 吸去冻存液上清,加入 1 mL 新鲜的完全培养基重悬细胞,将细胞悬液接种至含有 3 mL 含完全培养基的 6 cm 培养皿中,轻轻晃匀后置于 37 ℃、5% CO2 培养箱。
(4) 24 h 后更换一次培养液继续培养,待细胞融合度达 80% 左右传代培养,保持细胞良好的生长状态。
2.目的细胞腺相关病毒感染
贴壁细胞:
(1)细胞铺板:感染前一天用 293 T 细胞接种一块 96 孔板,培养24 h后细胞密度达到 30%~40% 进行感染。
(2)病毒感染:取出接种 24 h 后的 293 T 细胞板,标记后,取待感染病毒样品,感染相应的孔,每孔加入 5 μL 样品(正常的 AAV 病毒滴度在 1 E + 12~1 E + 13 v.g/mL)后,放入培养箱,继续培养 48 h。
(3)感染情况确认:感染后 48 h 取出孔板在荧光显微镜下观察并判定病毒感染效率。
悬浮细胞:
(1)按照预实验确定的感染条件,将约 1 E + 5 个 HeLa 细胞,装入 12 孔板中,在 37 度下孵育 12 小时;
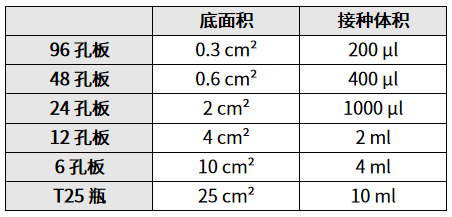
(2)用 IMDM 清洗一下细胞,加入 AAV,MOI 值为100~10000设置梯度,感染 1 小时;
(3)在 IMDM 培养基中加入 10% NCS 和 1% 抗生素,培养 48 小时。
3. 观察感染后细胞状态及感染效率
(1) 细胞状态良好,未出现大量死亡现象,特别是保证 NC 组与 CON 组细胞状态相当。
(2) 腺相关病毒感染 48~72 h 后观察荧光,确认感染效率。
4.细胞状态良好,感染效率合格组,可用于下游检测;否则重新感染。
注:操作时污染了病毒的管子和枪头以及培养基和最后的细胞都需要用消毒液处理后才能丢弃。
注意事项
(1)腺相关病毒没有配套的助感染试剂,如果感染目的细胞效率低,建议加入腺病毒作为辅助病毒。
(2)感染细胞的腺相关病毒血清型尽量选择 DJ 型,DJ 型是一种混合血清型,适合细胞实验。
(3)AAV 一般用于动物体的基因递送,部分细胞可能无法感染(或者需要加特定的因子才能有效感染);若感染失败,细胞实验请采取慢病毒、腺病毒等进行实验。
来源:丁香实验