合作专家 | 郭新容硕士
临床医学 中南大学
审核专家 | 李娜硕士
生理学 大连医科大学
简介
肿瘤类器官先前已被证明可以对衍生它们的肿瘤进行表型分析,从而允许体外药物反应与原始肿瘤中存在的遗传改变相关联。
原理
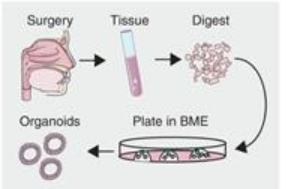
从手术标本中显微解剖上皮层以去除脂肪和肌肉,在 0.125% 胰蛋白酶或 TrypLE Express 中消化并过滤,然后将所得细胞悬液接种基底膜提取物(BME),基质胶等效物。
在铺板后的最初几天内,类器官从单细胞或小细胞团块中生长出来。
随着时间的推移,这些类器官发展成致密的结构,通常具有角质化中心。平均而言,类器官可以在 10~14 天内传代。在第一次传代后,类器官通常呈指数级扩增,每 10 天传代一次,分流比为 1:5。
用途
基础和转化癌症研究、药物开发、个性化医疗。
材料与仪器
步骤
1、收集肿瘤和正常组织材料:从患者病理组织中收取病变组织,将组织放入 Advanced DMEM/F12+++ 培养基(含 1×GlutaMAX,青霉素-链霉素,10 mmol/L HEPES),培养基提前加入 10 µM ROCK 抑制剂 Y-27632。
对于正常组织样本,去除多余的脂肪或肌肉组织富集上皮细胞,并将组织切成 1~3 mm3 的小块。将细胞小块置于含 0.125% 胰蛋白酶的 Advanced DMEM/F12+++培养基于 37℃ 孵箱中进行消化。
每 10 min 使用 1 mL 移液管吹打组织悬液 1 次。密切监测消化,以防止在胰蛋白酶中过度孵育,消化时间不宜超过 60 min,镜下观察到细胞团块由 2~10 个细胞组成时,即表示消化完成。
完成后,消化酶通过添加 10 mL Advanced DMEM/F12+++ 培养基。悬浮液经 100μm Easy Strainer 滤器过滤,并以 1000 rpm 离心。将所得颗粒在类器官培养基中重新悬浮于冰冷的 70% 10 mg/mL 冷 Cultrex 生长因子减少的 BME 中。将约 10 μL 的液滴镀于预热的悬浮培养板。镀板后倒置置于 37 ℃、30 分钟,使 BME 凝固。随后,在培养皿中加入预热的类器官培养基。
第 1 周,在培养基中加入 10 µM ROCK 抑制剂 Y-27632 和 100 µg/ml Primocin,HNSCC 类器官培养基中额外添加 0.5 µg/ml caspofungin,以促进组织类器官的生长。
2、HNSCC 和正常上皮来源的类器官在 Advanced DMEM +/+/+中生长。
类器官培养基包含 1×B27、1.25 mmol/L n-乙酰-L-半胱氨酸、10 mmol/L 烟酰胺、50 ng/mL 人 EGF、500 nmol/L A83-01、10 ng/mL 人 FGF10、5 ng/mL 人 FGF2、1 μmol/L 前列腺素 E2、0.3 μmol/L CHIR 99021、1 μmol/L Forskolin、4% R-spondin 和 4% Noggin。
小鼠类器官与人类类器官保持相似,但在 Advanced DMEM +/+/+培养基环境下生长,含有 B27、25 mmol/L N-乙酰-L-半胱氨酸、10 mmol/L 烟酰胺、2% RSPO、50 ng/mL EGF 和 10 ng/mL FGF10。
3、类器官在初次移植后 7~14 d 分裂。通过 P1000 干扰 BME 液滴,在 10 mL Advanced DMEM/F12+++ 培养基中收集和洗涤,从培养皿中收集类器官用于传代。
4、将颗粒重悬于 1 mL TrypLE Express 中并在 37 ℃ 孵育。密切监测消化过程,每 5 分钟将悬浮液上下滴入,以帮助破坏类器官。加入 10 mL Advanced DMEM +/+/+将类器官分解成单细胞后,停止类器官消化。
随后,将细胞重新悬浮在 70% 的冷 BME 中,并以合适的比例(1:5 至 1:20)进行培养,以使新的类器官有效生长。
5、细胞分裂后加入 10 μmol/L Y-27632 促进类器官的生成。每 2~3 d 更换培养基,每 1~2 周分裂类器官 1 次。
注意事项
1、基础培养基之外的添加因子就会随着肿瘤类型的不同而发生变化;
2、培养板提前 24 h 于 37 ℃ 预热,以确保 BME 加入后能迅速凝固,防止其散开,细胞贴壁;
3、取材时要区分正常组织和肿瘤组织,在提取肿瘤组织时,要尽量提取富含血管(呈现粉红色)和含有上皮细胞的部位,剔除坏死组织(黄色或黑色)、脂肪以及肌肉组织。
4、种板细胞中的肿瘤干细胞是肿瘤类器官形成的种子细胞,而肿瘤干细胞在消化后的肿瘤组织悬液中比例极低,这就要求我们种板的密度不能太低,但是太高的种板密度会导致由过多的其它肿瘤细胞凋亡引起的肿瘤类器官培养失败。
5、肿瘤组织样本在取材以及运输过程中可能会引起污染,这就要求我们在取材源头上就要注意可能带来的污染,并无菌操作。
6、肿瘤类器官的鉴定可以从组织病理学进行形态结构观察(细胞水平)、肿瘤标志物的染色鉴定(蛋白水平)、基因表达变化及基因突变分析(基因水平)、药敏活性测试(功能应用)这四个层面鉴定了癌类器官;
7、弃去培养基后,加入预冷基质胶回收液吹打基质胶,将培养孔内的基质胶全部回收后离心,弃去胶回收液,加入 Tryple 消化液进行消化,一般消化 10~15 min,期间可在镜下观察,若类器官团块大部分解离为 3~10 个的细胞团时,则停止消化。
8、消化后细胞进行传代,此时的细胞含有大量的肿瘤干细胞,消化后的每个细胞小团块都可能会形成类器官,可根据之前收获类器官时培养孔内类器官的生长个数和大小综合考虑传代密度,一般以第一代的肿瘤类器官种板密度达到 20~30% 为宜。
来源:丁香实验