简介
磁性细胞分选器分离(MACS)法即利用细胞表面标志,达到分离纯化 NK 细胞的目的。分离方式有阳性选择法和阴性选择法两种形式(具体操作参照实验时使用的试剂盒说明书)。
原理
磁性细胞分选器分离(MACS)法的基本原理是利用细胞表面标志,达到分离纯化 NK 细胞的目的。分离方式有阳性选择法和阴性选择法两种形式:
一、阳性选择法
人 NK 细胞的表型为 CD56#-CD16+CD3-CD19- CD14-CD15,在反应中加入 NK 细胞表面标志分子 CD16 抗体,该抗体为磁珠标记(此为直接法),使 NK 细胞与之特异结合形成磁性免疫复合物留于磁柱内。不表达 CD16 表面抗原分子的细胞由于不能与磁珠结合的特异性抗体结合,不能在磁场中停留,而被洗脱,因此能够分离和纯化 CD16+的 NK 细胞。原理如下图 12-1。
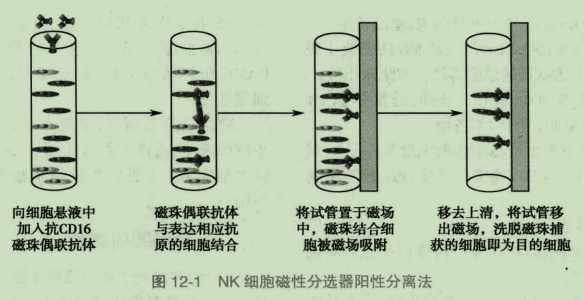
二、阴性选择法
人 NK 细胞的表型为 CD56#CD16+CD3-CD19CD14 CD15,采用磁珠标记抗体的方法可以去掉人外周血中的 T 细胞(CD3+)、B 细胞(CD19*)以及单核细胞(CD14*)。从外周血中分离出单个核细胞,以贴壁法去除其中的单核细胞后,用尼龙毛柱法去除其中的 B 细胞,余下的 T 细胞和 NK 细胞再与抗 CD3 标记的磁珠混合,使 T 细胞形成磁性复合物留于磁性分离柱内,未结合的细胞即为 NK 细胞。
材料与仪器
步骤
一、阳性选择法的基本过程可分为以下几步:
(1)聚蔗糖-泛影葡胺法分离外周血单个核细胞。
(2)除去黏附的单核细胞和 B 细胞:用 10%FCS-RPMI 1640 调细胞浓度为 4x106/mL,加入无菌塑料平皿,37 ℃5%CO2 培养 2 小时。上清中剩余的 B 细胞和剩余的单核细胞,可采用尼龙毛柱分离法收集洗下的 T 细胞和 NK 细胞。
(3)磁珠分选 NK 细胞:上一步得到的 T 细胞和 NK 细胞混合液用磁珠分选法进行分离(具体参照试剂盒说明书)。
(4)取 1%BSA-PBS 10 mL,300 g 离心 8 分钟,洗涤 2 次。将上述细胞在 1.5 mL 离心管中重悬至 10/mL,置于 4 ℃ 备用。将抗 CD16 单抗加入细胞中(终浓度为 10 μg/mL),4 ℃ 或冰浴孵育 30 分钟。
(5)1%BSA-PBS 500 g 离心 1 分钟,洗涤 2 次。
(6)用 0.8 mL 1%BSA-PBS 将上述细胞在 1.5 mL 离心管中重悬,加入 200 μl 羊抗小鼠 IgG 包被的磁珠,4 ℃ 或冰浴孵育 30 分钟,并每 5 分钟混匀一次。
(7)1%BSA-PBS 500 g 离心 1 分钟,洗涤 2 次。1 mL 1% BSA-PBS 离心管中重悬细胞,室温备用。
(8)将经 1% BSA-PBS 预洗的 MS 柱安装于磁铁架上,加入上述制备的细胞悬液。待悬液全部流出后,用 1 mL PBS 轻洗 MS 柱 10 次。
(9)从磁铁架上取下分离柱,用 3 mL 1%BSA-PBS 冲洗磁珠结合的细胞,重复冲洗 3 次,300 g 离心 5 分钟,适量体积 1%BSA-PBS 重悬细胞,置于 4 ℃ 备用。
(10)流式细胞术检测细胞纯度及标记 7-氨基放线菌素 D(7-AAD)或碘化丙啶(PI),检测细胞活力。
二、阴性选择法的基本过程可分为以下几步:
(1)分离外周血单个核细胞。
(2)除去黏附的单核细胞和 B 细胞:用 10%FCS-RPMI 1640 调细胞浓度为 4x106/mL,加入无菌塑料平皿,37 ℃5%CO2 培养 2 小时。上清中剩余的 B 细胞和剩余的单核细胞,可采用尼龙毛柱分离法收集洗下的 T 细胞和 NK 细胞。
(3)磁珠分选 NK 细胞:上一步得到的 T 细胞和 NK 细胞混合液磁珠分选法进行分离(具体参照试剂盒说明书)。
(4)取 1%BSA-PBS 10 mL,300 g 离心 8 分钟,洗涤 2 次。将上述细胞在 1.5 mL 离心管中重悬至 10/mL,置于 4 ℃ 备用。
(5)将抗 CD3、CD19 及 CD14 抗体加入细胞中(终浓度为 10 μg/mL),4 ℃ 或冰浴孵育 30 分钟。
(6)1%BSA-PBS 500 g 离心 1 分钟,洗涤 2 次。
(7)用 0.8 mL 1%BSA-PBS 将上述细胞在 1.5 mL 离心管中重悬,加入 200 μl 羊抗小鼠 IgG 包被的磁珠,4 ℃ 或冰浴孵育 30 分钟,并每 5 分钟混匀一次。
(8)1%BSA-PBS 500 g 离心 1 分钟,洗涤 2 次。1 mL 1% BSA-PBS 离心管中重悬细胞,室温备用。
(9)将经 1% BSA-PBS 预洗的 MS 柱安装于磁铁架上,加入上述制备的细胞悬液。收集流出液。
(10)流出液 300 g 离心 5 分钟,适量体积 1%BSA-PBS 重悬细胞,置于 4 ℃ 备用。
(11)流式细胞术检测细胞的纯度及标记 7-氨基放线菌素 D(7-AAD)或碘化丙啶(PI),检测细胞活力。
注意事项
(1)使用前的磁珠,应充分洗涤以排除防腐剂及保护剂的干扰。
(2)每一步反应结合后的细胞收集,应充分洗涤防止抗体细胞之间的非特异结合。
(3)上分离柱前,特别是消化分离的贴壁培养细胞,应充分混匀,避免出现细胞团块。
(4)抗体包被磁珠对死细胞常有非特异性结合,因此尽量使用新鲜分离的细胞。
(5)用分离柱分选,细胞悬液加入防止产生气泡,使分离柱不被气泡阻滞。
(6)分选细胞量应根据说明书推荐的使用范围,避免过多或过少。
(7)孵育时间和温度应按说明书进行,延长孵育时间、提高温度会增加非特异结合。
来源:丁香实验









