肽物质过层析柱分不开峰
dxy_rvfdror8
将超滤结束后的样液过葡聚糖凝胶G-15,上样之前过0.45um膜,浓度做过25mg/ml、50mg/ml,柱子长是1.6×50,上样量为3ml,转数大概10分钟可以收集3ml,样为2KDa以下的肽,做了十几次,出峰大都稳定在十几到三十几出峰,但是峰分不开的,不知道是什么原因,救救孩子吧

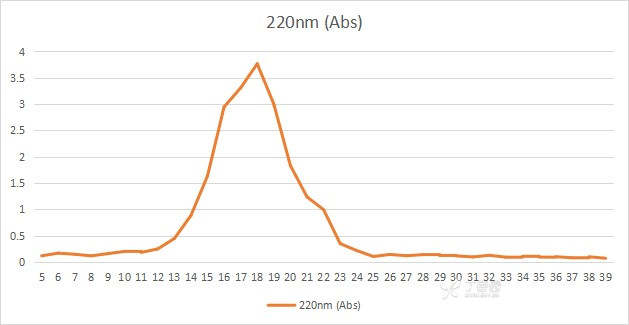
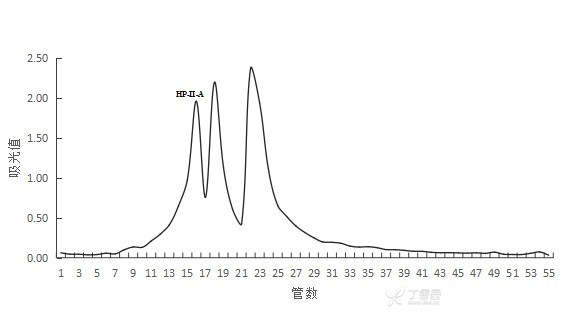
3 个回答
sswei
原因主要有几种:
1 流动相不合适,更换流动相及重新摸配比。
2 可以通过调整流速达到更好的分离结果,如原来的1 ml/min,调到0.7ml/min,可能会有意想不到的效果。
3 还有一种可能是化合物部分氧化,用流动相按1:1稀释之后,再跑一次,可能分叉就没有了。
土井挞克树
还是过凝胶的孔径太靠近了,所以分不出峰,建议把孔径调整下,把各个物质区分开
loveliufudan
以下是一些建议和可能的原因:
1. 样品浓度:样品浓度可能对分离结果产生影响。你可以尝试调整样品的浓度,以查看是否对峰的分离产生影响。可能需要优化样品的浓度以获得更好的分离效果。
2. 柱子选择:葡聚糖凝胶G-15是一种分子量截断为15,000道尔顿(Da)的凝胶。如果你的目标是分离2 kDa以下的肽,可能需要考虑使用更适合的柱子,例如G-10或G-5。
3. 柱子尺寸:你提到柱子的尺寸为1.6×50,这是指直径为1.6 cm,高度为50 cm的柱子。柱子的尺寸也可能影响分离结果。较长的柱子可能有更好的分离效果,你可以考虑尝试更长的柱子以提高分离性能。
4. 流速和采集时间:你提到转数大约为10分钟可以收集3 ml。你可以尝试调整流速和采集时间,以确保样品在适当的时间内经过柱子。如果流速过快,可能会导致组分未完全分离。
5. 柱子预洗和平衡:在使用柱子之前,请确保对柱子进行充分的预洗和平衡步骤,以消除可能的非特异性吸附和背景峰。