外周血提RNA降解
dxy_wwgvdgi8
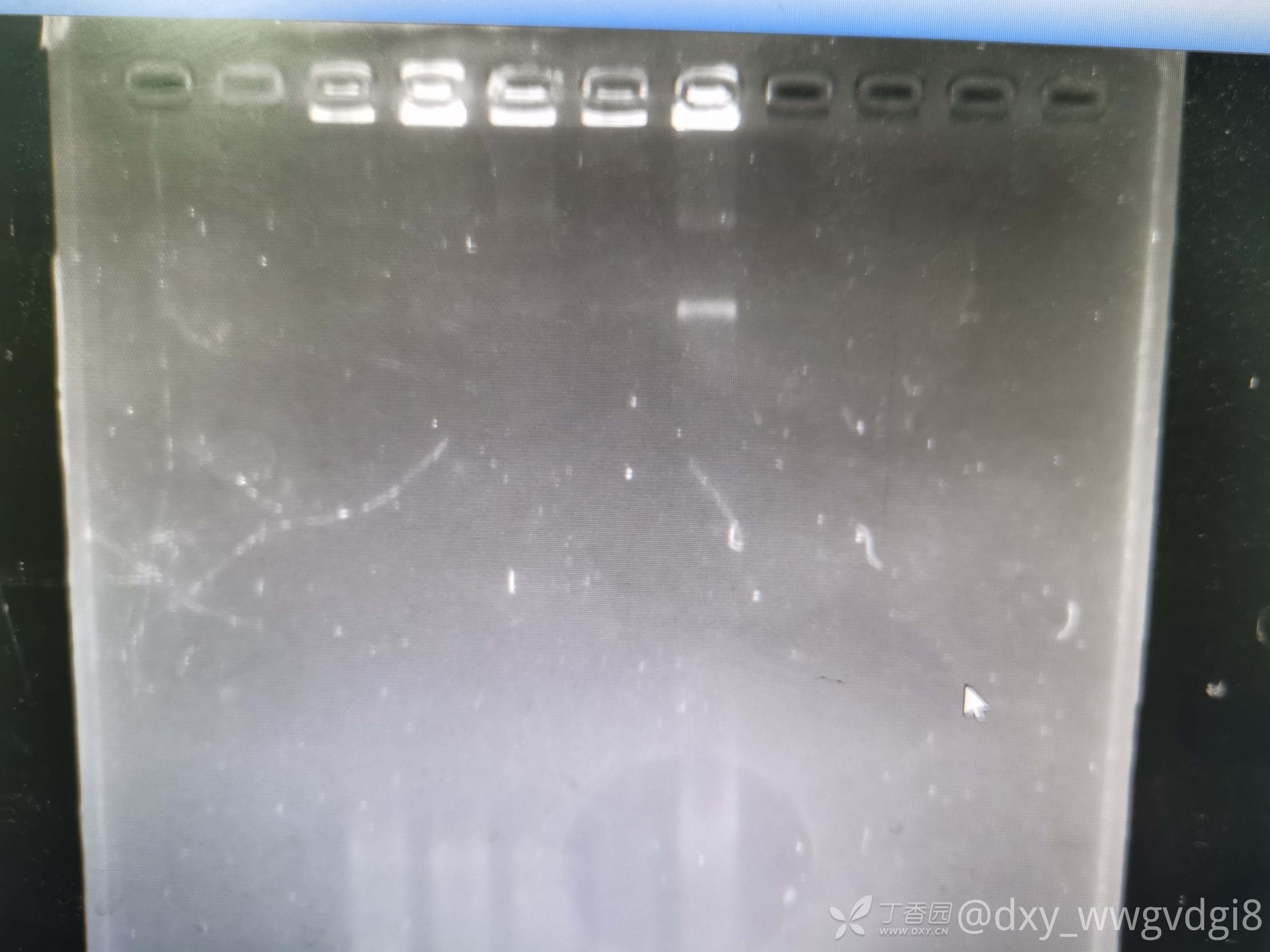
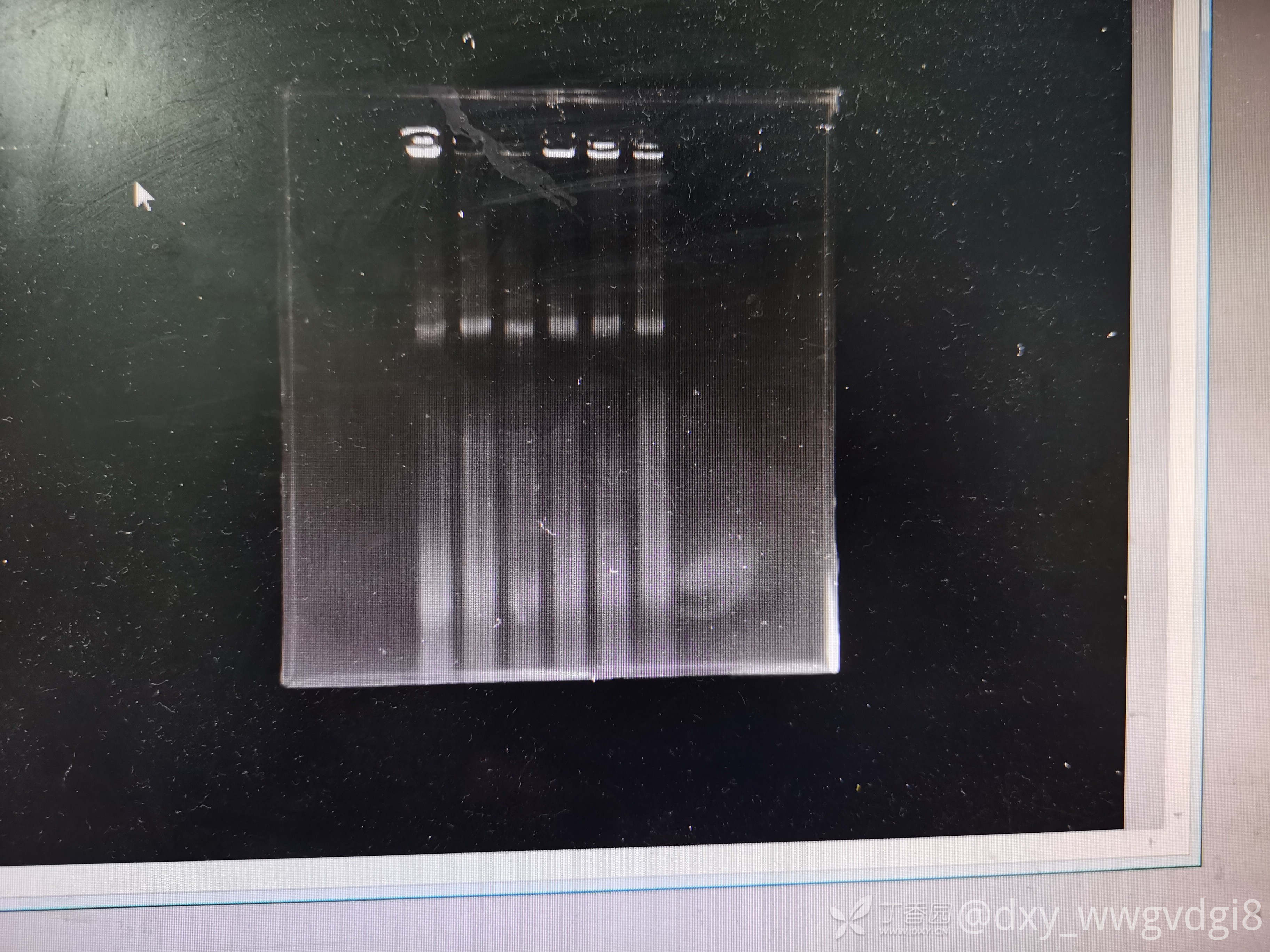
请问大家有没有好的方法提取血中的RNA呀,我是用紫色管子取血,然后离心,分离出血细胞之后,400ul血细胞+800ul的trizol,然后接下来的步骤就是按说明书上来进行的了。提出来RNA浓度还可以,但是纯度不行,OD260/230值很低,大部分不超过1,跑琼脂糖凝胶电泳之后,没有三条条带,应该是降解了(下面的图是三次提取后跑的胶,用1%TBE跑的,loadingbuffer就是跑dna用的6x buffer)。
我老板最近想让我完善一下提取RNA的方法,在园子里看了一些经验帖,好像和我的方法差不多,提取PBMC后再提RNA的方法好像也会降解,不知道该怎么办才好了😭,另外全血提RNA和先提PBMC再提RNA的区别在哪里呢?谢谢各位大佬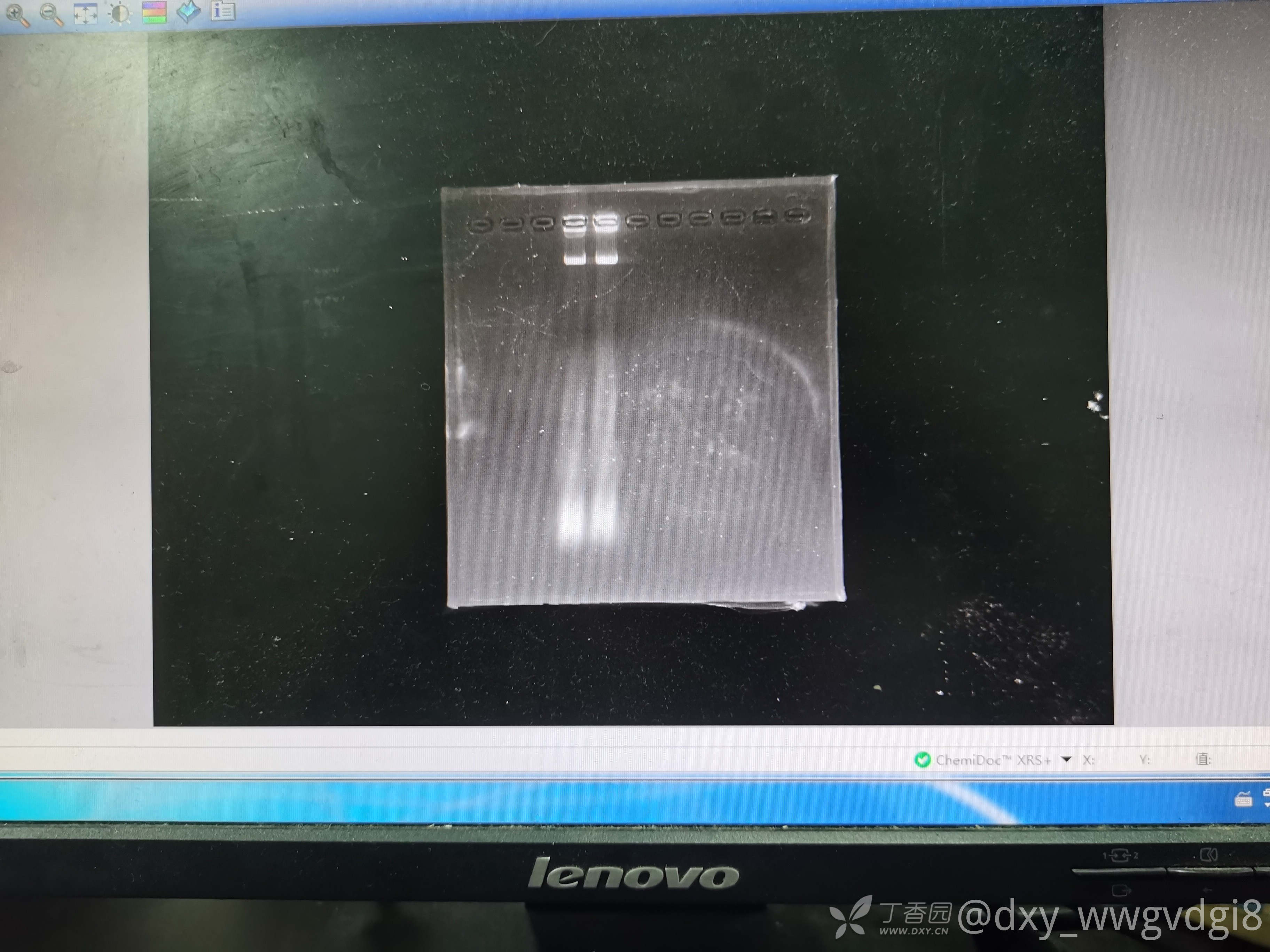
3 个回答
huarenqiang5
可以按以下实验步骤进行:
1.收集新鲜人血液并立即用Ficoll分离白细胞。
2.用冰冷PBS洗涤外周血淋巴细胞3次。
3.在50ml塑料离心管中收集外周血淋巴细胞,并加入7ml裂解缓冲液(可溶解达到5×108个外周血淋巴细胞),然后剧烈涡旋振荡以溶解细胞。
4.加入7体积(49m1)4molL氯化锂,4°℃孵育15~20小时(过夜)。
5.将悬液转移到30mlCorex管内,在吊桶式转头内4°℃离心2小时,6500r/min。
6.弃去上清,并用Kimwipe擦拭试管口。用
3molL氯化锂(大约15ml)重悬,收集沉淀.将沉淀重悬液离心,6500r/min 1小时。
7.弃去上清,用2m1RNA溶解液溶解沉淀。在-20℃下,彻底冷冻悬液。
8.复溶悬液,每10分钟涡旋20秒,共45分钟。9,用等体积酚抽提1次,并用等体积氯仿抽提1
次。
10.加入1/10体积的3mol/L乙酸钠,pH4.8和2体积-20℃乙醇。彻底混合溶液,并在-20℃下孵育过夜。
11.在吊桶式转头内离心RNA,12000r/min 30分钟。用0.2m1DEPC处理水重悬沉淀。将溶解的
DNA转移至1.5m1微量离心管内,并加入1/10体积3molL乙酸钠,pH4.8和2体积-20°℃乙醇,重新沉淀。并以乙醇沉淀物形式保存RNA,直至准备使用时。
loveliufudan
RNA的提取方法一般分为有机物提取法和硅胶膜筛选法两种。
有机物提取法,如您提到的使用Trizol试剂提取RNA,通常适用于细胞和组织样本的RNA提取。但是,血液样品中存在大量的红细胞和其他细胞碎片,这些细胞碎片可能会影响RNA的质量和纯度。您可以尝试使用RNA血浆/血清分离试剂盒,可以将血液样本中的RNA分离出来,减少细胞碎片的影响。
硅胶膜筛选法是另一种RNA提取方法,适用于小样本和低浓度RNA样品的提取。硅胶膜筛选法可以更有效地去除DNA、蛋白质和其他杂质,提高RNA的纯度。您可以尝试使用商业化的RNA筛选试剂盒,如RNeasy Mini Kit,这些试剂盒使用硅胶膜筛选法提取RNA。
另外,全血提RNA和先提取PBMC再提RNA的主要区别在于前者包含了血液中的所有细胞类型,后者只包含PBMC,即淋巴细胞和单核细胞。根据研究的需要,您可以选择适当的RNA提取方法。
最后,如果您遇到了RNA质量和纯度的问题,可以尝试优化RNA提取的条件,例如调整Trizol的使用量、离心速度和离心时间等因素。同时,RNA样品的处理和保存也非常重要,建议尽快进行下一步实验,避免RNA的降解和损失。
土井挞克树
提取后立即冷存,提高提取量减少降解量
相关产品推荐
相关问答