求助各位大神,我已经做了三次血清提取RNA了,每一次的OD260/280还有260/230值都很低
潇濛潇濛
这是我的实验步骤:
1.取200ul血清移入EP管,加入Trizol1ml,手动震荡30s,冰上静置10min
2.加入200ul氯仿,手动震荡30s,冰上静置15min
3.离心:14000r,15min,4℃
4.轻轻取出无酶EP管,枪头吸取上层水相,移入新的EP管
5.加入等体积异丙醇,再加入2ul助沉淀剂,颠倒混匀,-80℃过夜
6.拿出后冰上静置15min
7.离心:14000r,10min,4℃
8.吸取上清丢弃(应见沉淀)
9.加入500ul 75%乙醇,温和手动震荡
10.离心:8000r,5min,4℃
11.轻轻取出,吸取上清丢弃,空气中静置15min,去除残余乙醇
12.加入20ulDEPC水稀释,冰上静置10min,以溶解RNA沉淀
13.测RNA浓度:
用卫生纸擦干净,先用1ulDEPC水调零,每次加1ulRNA测出浓度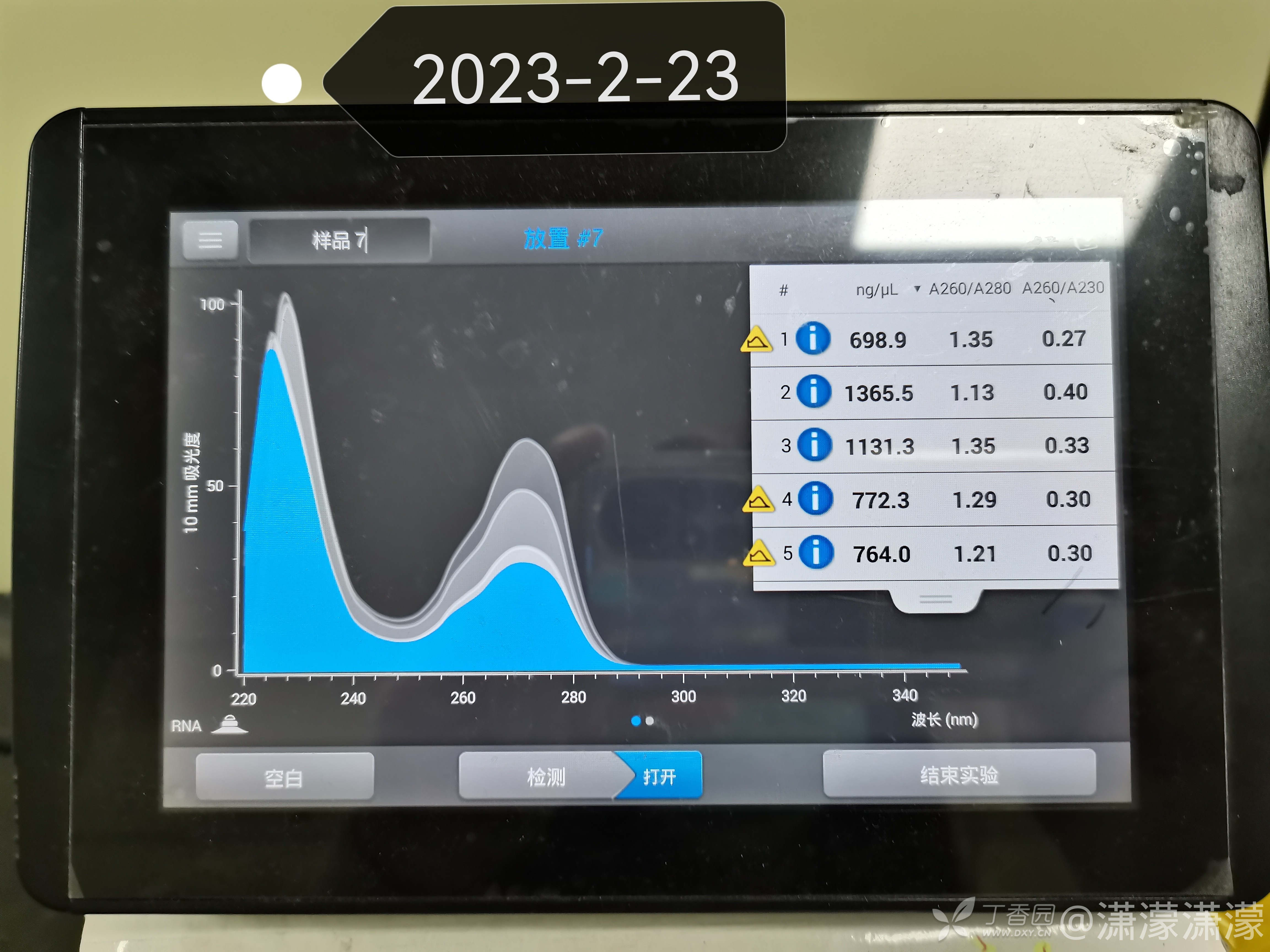 有没有大神跟我说一下有可能出现的错误吗?万分感谢!
有没有大神跟我说一下有可能出现的错误吗?万分感谢!
3 个回答
土井挞克树
我觉得你可以把样本浓缩一下再进行提取,血清目前你提取的量太少,或者改进一下方法
huarenqiang5
这个情况主要考虑以下几点误区:
1.认为4度离心很好,其实4度离心只有坏处,没有好处。
2.误认为提取RNA/DNA不用跑电泳,只要测OD吸光值/OD比值就可以知道浓度和纯度。核酸纯化,大家最大的误解,就以为测出来OD值吸光值就是测出来了核酸的浓度,这个概念是不对的。测OD值,只是测总吸光值,它不能等同于测的是真实核酸浓度。总吸光值可以来源于真正的核酸,也包含来源于残留的杂质,残留的蛋白,残留的降解的RNA/DNA,它们都有吸光值,所以测量的总吸光值OD值换算的浓度,不代表这都是纯核酸的浓度,也可能包含了来源于残留的杂质,降解的RNA,残留的蛋白等等的吸光值换算的浓度。这当然不是真正的纯核酸的浓度。只有在我们提供的核酸(RNA,DNA)是100%纯的时候,测量的OD值浓度才是真正能100%换算成核酸浓度。
3.误认为纯的RNAOD260/280比值是1.8-2.1 或者误认纯的RNA比值是1.8-2.1, 超过2.0或者2.1就降解了。这是完全误解了, 纯的RNA的OD260/280比值是2.2,比值2.1-2.2不但不一定是降解,反而可能是纯度高的标志。 只有超过2.3才提示降解。
4.误认为RNA的OD260/230比值偏低,甚至很低的RNA质量不行,无法用于下游实验。这个是一个非常流行的误解,也是危害最大的误解。真相是:OD260/230偏低,大部分是因为提取RNA试剂用到的异硫氰酸胍的残留导致了OD230吸光值升高从而导致OD260/230偏低,但是这种残留的微量异硫氰酸胍在绝大部分情况下完全不影响下游的反转录/荧光定量/测序建库等实验。实验证明,即使残留0.1mM的异硫氰酸胍,也足够被分光光度计检测出来(导致OD260/230测量比值大幅度降低)。但是即使残留100mM 异硫氰酸胍,也不会抑制下游的反转录荧光定量PCR。而实践中,残留异硫氰酸胍达到100mM的情况基本不可能,即使真出现了这种极端高的残留,也不影响下游反转录荧光定量。所以OD260/230比值低,根本不能用于判断RNA的质量好坏,不能用来判断是否可以用于下游实验。RNA提取常用到的异硫氰酸胍往往都会在提取的RNA里面有微量残留,因为分光光度计极其灵敏,非常低的残留就能导致OD260/230比值偏低从而被机器检测出来。但是这个极其微量的残留,完全不影响RNA用于下游的反转录荧光定量,不影响用于下游的测序建库。
loveliufudan
根据您提供的实验步骤和OD260/280值和260/230值很低的情况,可能会有以下一些可能的错误:
操作不严谨:在操作提取RNA的过程中,可能会有污染物进入,导致提取到的RNA浓度较低。建议在操作过程中严格控制污染源,例如使用RNAase-free的管嘴、枪头、手套等,并在实验前进行消毒处理。
质量差的试剂:试剂的质量会直接影响到RNA提取的效果,如果使用的试剂质量不佳,例如Trizol、氯仿、异丙醇等,都可能会导致提取到的RNA质量较低。
RNA被分解:RNA分解是RNA提取和测定中的一个常见问题。在提取和储存RNA过程中,应避免长时间曝露在空气中,同时应尽量使用RNase-free的试剂和器具。如果RNA已被分解,则其OD260/280值和260/230值将会降低。
测定错误:在测定RNA浓度时,可能会出现误差。建议使用专业的分光光度计进行测定,并根据操作说明书正确进行操作。
综上所述,为了提高RNA的提取质量,建议您在操作过程中注意控制污染源、使用高质量的试剂、避免RNA被分解、并正确测定RNA浓度。
相关产品推荐
相关问答