膜蛋白纯化攻略分享
Cytiva(思拓凡)
采用亲和加分子筛两种层析方法就能得到大量高纯度的蛋白样品往往是别人家的实验。到自己手上总会有各种惊喜…
今天的主角更加过分,在真正纯化之前就需要我们施展十八般武艺把它从细胞上「拽」下来。
没错,它就是膜蛋白…
人类基因组中,有大约 30% 的基因编码膜蛋白。当今已批准上市的药物中,有超过 50% 以膜蛋白为靶点,然而目前蛋白质结构数据库 (Protein Data Bank, PDB) 中膜蛋白比例不足 1%。
欲了解其功能,必解析其结构。是很多结构生物学家心头的念念不忘,随着冷冻电镜技术的发展,会有更多的膜蛋白结构得到解析,助力后续的功能研究和药物发现。
有了冷冻电镜这把利器之后,真正制约膜蛋白研究的其实是样品的制备。
常规的膜蛋白制备流程如下:
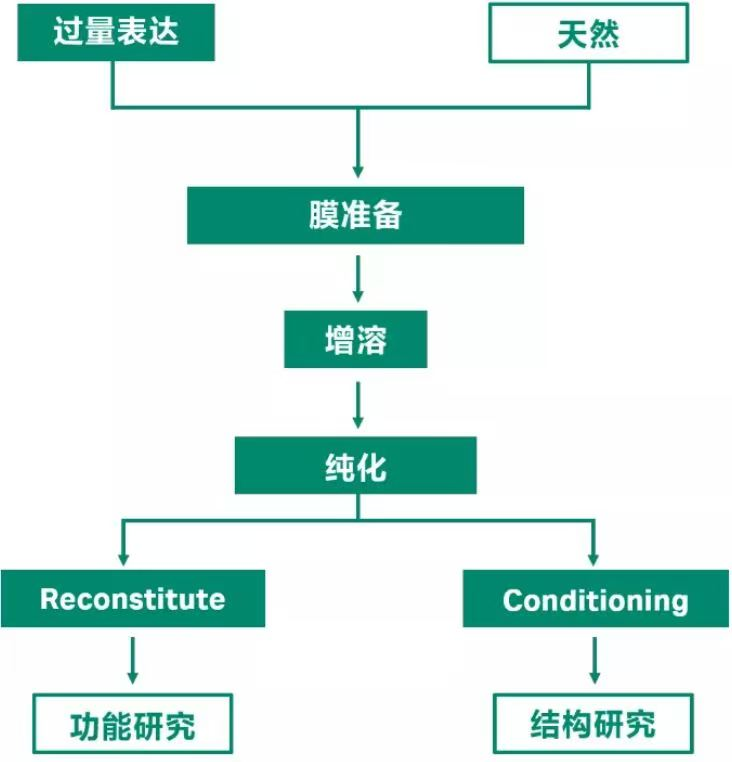
图 1. 常规的膜蛋白制备流程图
特点是:
- 蛋白含量低
- 收率低
- 活性易降低
- 纯化过程需要优化
去垢剂
天然表达的膜蛋白含量极低,很难纯化。就算是重组表达体系,生产出的膜蛋白通常具有细胞毒性,因此表达量也远低于常规重组蛋白。在整个纯化过程中都需要选择合适的去垢剂才能使膜蛋白本身保持空间构象和活性。
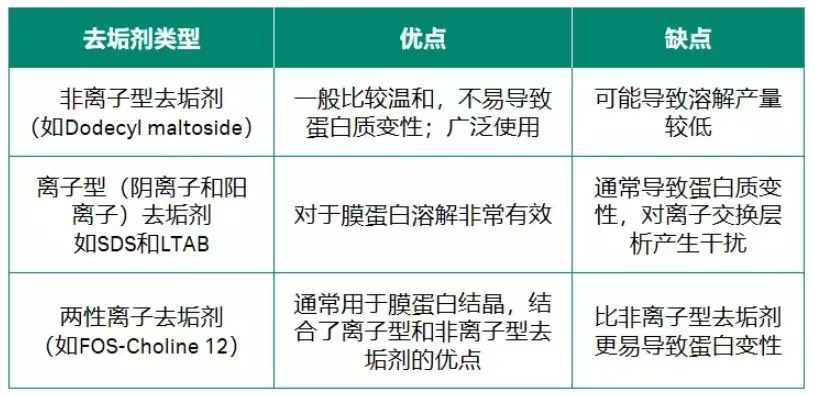
去垢剂可分为三种:
表 1. 去垢剂类型和特点表
常用的去垢剂大概有十几种,根据膜蛋白分子量可选用下面两根预装柱进行快速筛选:
表 2. 用两根预装柱快速筛选去垢剂结果表
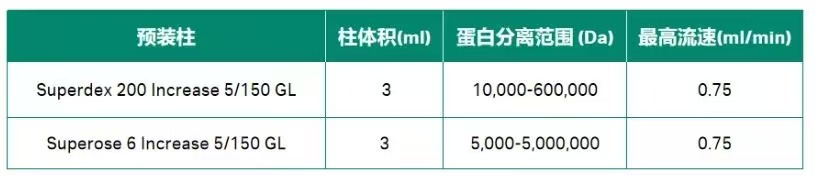
运行流速设为 0.5 mL/min,15 min 以内就可以筛选一个去垢剂,而且上样量 5-50μL,可节省样品。
标签
摸索得到合适的去垢剂之后,就可以进行常规的层析实验。
增溶之后,高速离心取上清过亲和层析柱,为了减少后续的处理步骤,往往设计较小的标签,一般使用 HIS 或者 Strep,如果使用 GST 标签,则需要引入酶切位点。
标签设计应遵循以下两点:
- 在C-端加入标签
- 使用长标签或者引入一段linker
由于膜蛋白 N 端信号肽的存在,标签只能加在 C 端。8—10 个组氨酸标签能够提高膜蛋白的结合强度,进而提高收率。
有时可以采取快速的方法进行第一步亲和层析。在细胞破碎阶段,直接加入去垢剂来溶解膜蛋白(不需要提前分离细胞膜),通过此法得到的上清可直接用 HisTrap FF crude 预装柱进行纯化,缩短实验时间。
分子筛 vS 离子交换
亲和层析之后,往往使用分子筛做最后的精纯,但如果杂质依然很多或者膜蛋白本身不带标签,则需要使用离子交换层析。
离子交换层析
离子交换层析推荐使用 RESOURCE 和 Capto HiRes 系列,能得到比较好的分辨率。不过要注意阴离子交换实验中不要添加阴离子型去垢剂,阳离子交换实验中则不能加入阳离子型去垢剂,以免影响层析柱载量。
离子交换之前需降低缓冲液中盐浓度,由于膜蛋白的特殊性,推荐使用脱盐柱进行此步骤,根据样品体积可选择 HiTrap Desalting 5 mL 或 HiPrep 26/10 Desalting 53 mL 两种常用柱型。最终上样体积不要超过柱体积 30%。
分子筛
膜蛋白的纯化流程中,分子筛是理想化的最终步骤。不仅可以去除聚集体以及与目的蛋白大小不同的杂质,还可以进行缓冲液更换。这些因素往往能够决定后续的结构测定是否顺利。
推荐使用高分辨率分子筛大体积预装柱 Superdex 200 Increase 10/300 GL 和 Superose 6 Increase 10/300 GL。其最大上样量可达 500μL。
案例分析
外膜蛋白 A (Outer membrane protein A, OmpA) 是革兰氏阴性菌外膜蛋白质的主要组分,也是一个关键的毒性因子,且与细菌生物膜合成、真核细胞感染、抗生素抗性和免疫调节息息相关。因此可作为一个潜在的药物靶点。
以下是从大肠杆菌中纯化非标签膜蛋白 0mpA 亚单位的流程。

图 2. 大肠杆菌中纯化非标签膜蛋白 0mpA 亚单位流程图
- 首先使用合适的去垢剂 C8E4,把 OmpA 膜蛋白溶解出来;
- 然后使用阴离子交换层析柱 RESOURCE Q 1 mL进行初步纯化,收集目标蛋白洗脱液;
- 浓缩后上样进行最后一步分子筛精纯,使用高分辨率层析柱 Superdex 200 Increase 10/300 GL,以得到高均一性和高纯度的 OmpA,利于后续的结构解析。
翻过膜蛋白纯化这座大山,以后纯化尽是坦途。
跃跃欲试了吗?那就去九大层析应用活动中先寻找心仪的装备吧!