免疫细胞杀伤的实时动态分析
德国赛多利斯集团
1208
探索病人自身的免疫系统在对抗肿瘤中的作用至关重要。抗癌反应的一个关键组成部分是免疫细胞,如细胞毒性T细胞和自然杀伤细胞,通过免疫细胞杀伤(ICK)过程诱导恶性细胞死亡的能力。
因此,在体外建立ICK模型至关重要。目前有多种传统技术可用于评估ICK,如流式细胞仪和各种生化读数等,然而,这些工具对洞察细胞间的动态相互作用仍然有限:
1. 采用耗时的“终点式”检测,每次检测只能获取一个时间点的结果;
2. 需要多次清洗,需要利用辐射性物质(如51Cr释放实验)或抗体标记(如流式细胞分析)进行定量分析;
3. 需要将多个时间点的不同样本(孔)数据关联在一起,以生成时程曲线,从而可能导致人为因素误差;
4. 检测时缺少环境控制而导致细胞变化,从而可能出现不需要或误导性的实验结果。
Incucyte®
提供全套免疫细胞杀伤方案,可实时查看和自动分析免疫细胞介导的肿瘤细胞杀伤作用,通过这种非侵入性、无干扰性的细胞分析平台对免疫细胞、抗体功能&杀伤能力获取新的见解。Incucyte®免疫细胞杀伤方案适用于研究:
- 细胞毒性T细胞杀伤
- 抗体依赖的细胞介导的细胞毒作用(ADCC)
- 在肿瘤球模型中的免疫细胞杀伤

01 实时查看免疫细胞和肿瘤细胞之间的相互作用及杀伤过程,并进行全自动化的分析。
1. 观察并量化免疫细胞与肿瘤细胞之间的动态相互作用
2. 揭示细胞之间的相互作用,从而深入了解细胞亚群之间的免疫突触
3. 使用非干扰试剂测量肿瘤细胞的死亡和对肿瘤细胞增殖的抑制作用
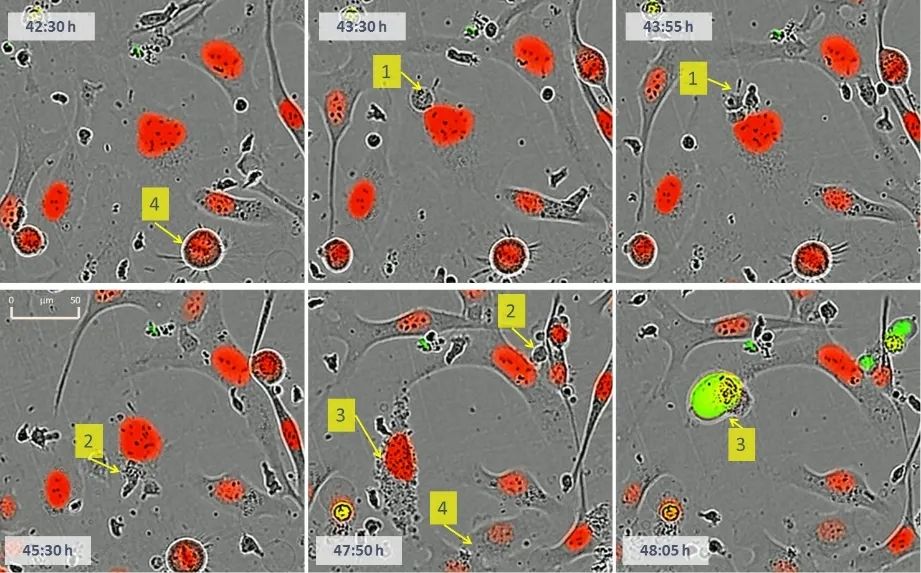 图3 利用Incucyte®免疫细胞杀伤试验查看免疫细胞/肿瘤细胞相互作用。(1)细胞毒性T细胞和红色荧光标记的肿瘤细胞之间的相互接触。T细胞分裂。(2)肿瘤细胞受到细胞毒性T细胞的攻击:“死亡之吻”。(3) 追踪肿瘤细胞凋亡(caspase 3/7绿色荧光标记)、核固缩和细胞死亡。(4)肿瘤细胞分裂。
图3 利用Incucyte®免疫细胞杀伤试验查看免疫细胞/肿瘤细胞相互作用。(1)细胞毒性T细胞和红色荧光标记的肿瘤细胞之间的相互接触。T细胞分裂。(2)肿瘤细胞受到细胞毒性T细胞的攻击:“死亡之吻”。(3) 追踪肿瘤细胞凋亡(caspase 3/7绿色荧光标记)、核固缩和细胞死亡。(4)肿瘤细胞分裂。

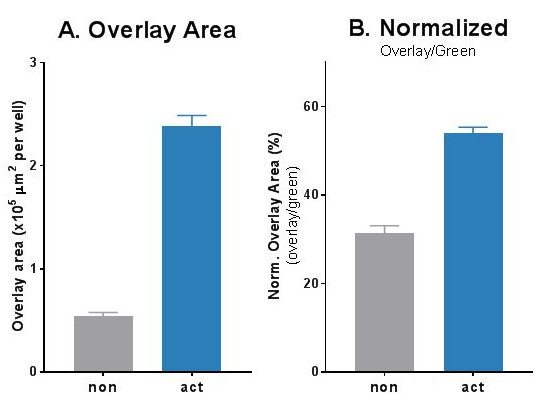 图4 使用Incucyte® FabFluor-488试剂,在共培养体系中查看和量化免疫细胞与肿瘤细胞之间的作用。A549肿瘤细胞(CytoLight Red荧光试剂标记)与预激活或未激活的PBMC共培养,加入Incucyte® FabFluor-488-α-CD45和Incucyte® Opti-Green试剂来标记淋巴细胞。加入PBMC 2小时后拍照显示CD45+细胞(绿色)和A549细胞(红色)之间的作用。相互作用(overlay,图示黄色mask)定量分析显示活化效应细胞与靶细胞的相互作用显著增加(结果见柱状图)。这一分析采用Incucyte® Cell-By-Cell 软件完成。
图4 使用Incucyte® FabFluor-488试剂,在共培养体系中查看和量化免疫细胞与肿瘤细胞之间的作用。A549肿瘤细胞(CytoLight Red荧光试剂标记)与预激活或未激活的PBMC共培养,加入Incucyte® FabFluor-488-α-CD45和Incucyte® Opti-Green试剂来标记淋巴细胞。加入PBMC 2小时后拍照显示CD45+细胞(绿色)和A549细胞(红色)之间的作用。相互作用(overlay,图示黄色mask)定量分析显示活化效应细胞与靶细胞的相互作用显著增加(结果见柱状图)。这一分析采用Incucyte® Cell-By-Cell 软件完成。
02 直接测量肿瘤细胞死亡和活性
1. 使用直观的Incucyte®图像分析工具有选择地量化肿瘤细胞增殖和凋亡。
2. 使用Incucyte® Caspase 3/7凋亡试剂检测肿瘤细胞凋亡,使用Incucyte® NucLight慢病毒试剂检测肿瘤细胞增殖。
3. 在细胞培养箱中全程监控肿瘤细胞的杀伤过程。可用于长期研究(>5天)。
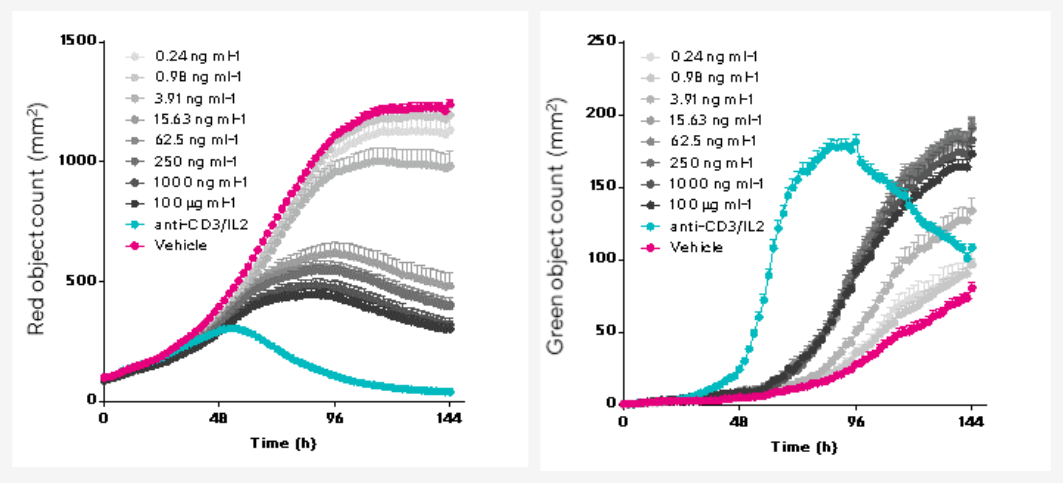
NucLight Red标记的SK-OV-3细胞与人PBMC共培养,并加入不同浓度的曲妥珠单抗(赫赛汀),用Incucyte® Caspase-3/7 Green试剂标记细胞凋亡。结果显示随着曲妥珠单抗浓度变化,SK-OV-3细胞增殖呈浓度依赖性降低,细胞凋亡呈浓度依赖性增加。
SK-OV-3细胞+未激活人PBMC
SK-OV-3细胞+预先激活的人PBMC
03 有多种灵活的共培养体系和方案供选择
1. 针对PBMC、细胞毒性T细胞(CD8+)和NK细胞与贴壁或悬浮肿瘤细胞共同培养的细胞免疫细胞杀伤方案
2. 在T细胞介导的细胞毒性和抗体依赖的细胞介导的细胞毒性(ADCC)试验中灵活选择效应细胞和靶细胞
3. 可采用3D肿瘤球模型,对免疫细胞杀伤进行实时查看和量化
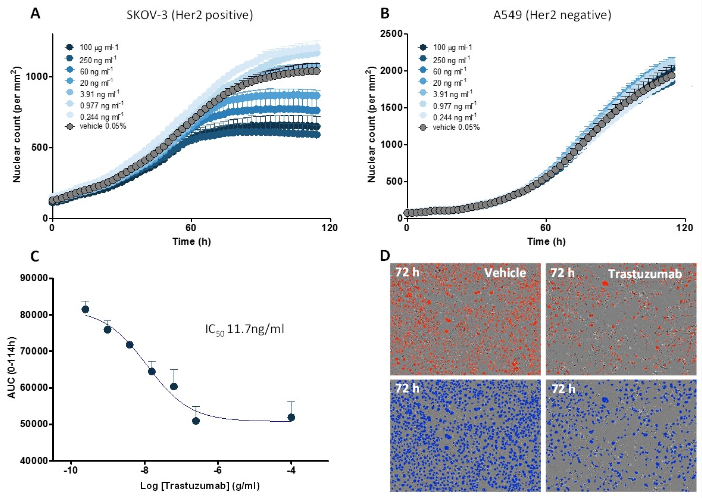 图6 将PBMC与SKOV-3(HER2阳性)或A549(HER2阴性)肿瘤细胞共培养,其中肿瘤细胞预先用NucLight Red荧光试剂标记。(A) 曲妥珠单抗诱导SKOV3肿瘤细胞增殖呈浓度依赖性抑制效应,(B) A549细胞未观察到抑制作用。(C) 曲妥珠单抗抑制SKOV-3细胞增殖的浓度反应曲线。(D) 对照组和曲妥昔单抗组在72小时的代表性图像。上一排是原始图像,下一排是mask图。
图6 将PBMC与SKOV-3(HER2阳性)或A549(HER2阴性)肿瘤细胞共培养,其中肿瘤细胞预先用NucLight Red荧光试剂标记。(A) 曲妥珠单抗诱导SKOV3肿瘤细胞增殖呈浓度依赖性抑制效应,(B) A549细胞未观察到抑制作用。(C) 曲妥珠单抗抑制SKOV-3细胞增殖的浓度反应曲线。(D) 对照组和曲妥昔单抗组在72小时的代表性图像。上一排是原始图像,下一排是mask图。
04 即混即读的96/384孔板方案,
可用于高通量筛选
1. 无需清洗,无需取出细胞,无放射性,无需抗体标记
2. 设置完实验即可走开,完全自动化的图像捕获和定量分析
3. 兼容流式细胞术和终点式生化测量——当检测完成时,采集细胞/上清液可用于下游试验

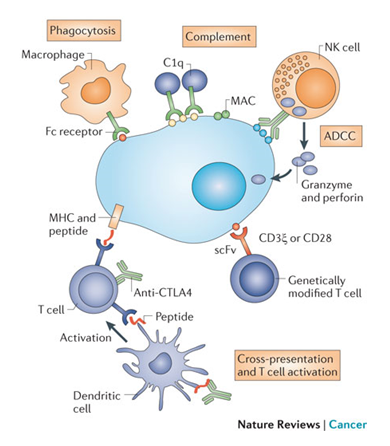
图1 各种免疫细胞或免疫组分在肿瘤免疫应答中的作用机制
因此,在体外建立ICK模型至关重要。目前有多种传统技术可用于评估ICK,如流式细胞仪和各种生化读数等,然而,这些工具对洞察细胞间的动态相互作用仍然有限:
1. 采用耗时的“终点式”检测,每次检测只能获取一个时间点的结果;
2. 需要多次清洗,需要利用辐射性物质(如51Cr释放实验)或抗体标记(如流式细胞分析)进行定量分析;
3. 需要将多个时间点的不同样本(孔)数据关联在一起,以生成时程曲线,从而可能导致人为因素误差;
4. 检测时缺少环境控制而导致细胞变化,从而可能出现不需要或误导性的实验结果。
Incucyte®
提供全套免疫细胞杀伤方案,可实时查看和自动分析免疫细胞介导的肿瘤细胞杀伤作用,通过这种非侵入性、无干扰性的细胞分析平台对免疫细胞、抗体功能&杀伤能力获取新的见解。Incucyte®免疫细胞杀伤方案适用于研究:
- 细胞毒性T细胞杀伤
- 抗体依赖的细胞介导的细胞毒作用(ADCC)
- 在肿瘤球模型中的免疫细胞杀伤

图2 采用Incucyte®活细胞分析系统分别检测免疫细胞对贴壁肿瘤细胞(SKOV-3,左图)、悬浮肿瘤细胞(WIL-NS,中图)和A549肿瘤球的杀伤作用(右图)。
Incucyte®免疫细胞
杀伤试验的主要优势
杀伤试验的主要优势
01 实时查看免疫细胞和肿瘤细胞之间的相互作用及杀伤过程,并进行全自动化的分析。
1. 观察并量化免疫细胞与肿瘤细胞之间的动态相互作用
2. 揭示细胞之间的相互作用,从而深入了解细胞亚群之间的免疫突触
3. 使用非干扰试剂测量肿瘤细胞的死亡和对肿瘤细胞增殖的抑制作用



02 直接测量肿瘤细胞死亡和活性
1. 使用直观的Incucyte®图像分析工具有选择地量化肿瘤细胞增殖和凋亡。
2. 使用Incucyte® Caspase 3/7凋亡试剂检测肿瘤细胞凋亡,使用Incucyte® NucLight慢病毒试剂检测肿瘤细胞增殖。
3. 在细胞培养箱中全程监控肿瘤细胞的杀伤过程。可用于长期研究(>5天)。
NucLight Red标记的SK-OV-3细胞与人PBMC共培养,并加入不同浓度的曲妥珠单抗(赫赛汀),用Incucyte® Caspase-3/7 Green试剂标记细胞凋亡。结果显示随着曲妥珠单抗浓度变化,SK-OV-3细胞增殖呈浓度依赖性降低,细胞凋亡呈浓度依赖性增加。

图5 用Incucyte®活细胞分析系统查看并量化ADCC效应。
03 有多种灵活的共培养体系和方案供选择
1. 针对PBMC、细胞毒性T细胞(CD8+)和NK细胞与贴壁或悬浮肿瘤细胞共同培养的细胞免疫细胞杀伤方案
2. 在T细胞介导的细胞毒性和抗体依赖的细胞介导的细胞毒性(ADCC)试验中灵活选择效应细胞和靶细胞
3. 可采用3D肿瘤球模型,对免疫细胞杀伤进行实时查看和量化

04 即混即读的96/384孔板方案,
可用于高通量筛选
1. 无需清洗,无需取出细胞,无放射性,无需抗体标记
2. 设置完实验即可走开,完全自动化的图像捕获和定量分析
3. 兼容流式细胞术和终点式生化测量——当检测完成时,采集细胞/上清液可用于下游试验
