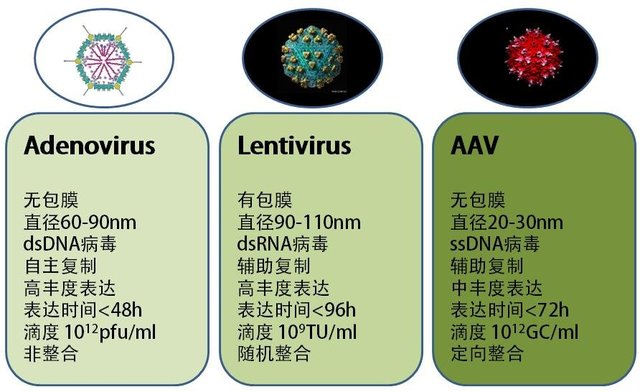
腺相关病毒高分论文应用案例
汉恒生物
《Science》中科大团队重磅发现:肿瘤免疫检查点疗法潜在新靶点
肿瘤诱导的免疫抑制是癌症逃避免疫监视和免疫攻击的主要原因。目前,免疫检查点疗法(ICT)在一些癌症的临床治疗中有很好的效果,其通过靶向细胞毒性T淋巴细胞相关抗原 4(CTLA-4)和程序性细胞死亡蛋白 1(PD-1)来逆转 T 细胞的免疫抑制。但是仍有大约 70% 的癌症患者对 ICT 不敏感,因此,寻找有效的 ICT 靶点是非常必要的。最新的研究表明,中枢神经系统可以调节癌症的发展和免疫系统的活动,其中主要途径是通过神经内分泌系统。垂体是神经内分泌系统的「指挥中心」,其一些下游激素或效应物在癌症患者中升高,提示神经内分泌系统和垂体单位可能参与调控肿瘤免疫,然而其中的机制仍不清楚。
2022 年 8 月 4 日,中国科学技术大学周荣斌教授作为第一通讯作者在《Science》(IF=63.714)上发表了题为《Pituitary hormone α-MSH promotes tumor-induced myelopoiesis and immunosuppression》的研究论文,深入探究了神经内分泌系统促进肿瘤相关的骨髓生成和免疫抑制及其机制。研究发现阿黑皮素原(POMC)经切割会产生α促黑激素(α-MSH),α-MSH 则通过相应的受体 MC1R—MC5R 发挥生物学功能。研究结果发现,MC5R 与 α-MSH 促进肿瘤发展密切相关,并提示 MC5R 是癌症免疫治疗非常有前景的一个靶点。值得注意的是,汉恒生物提供的腺相关病毒 HBAAV2/9-Hspa9 shPOMC-GFP 成功敲低了小鼠垂体中的 POMC,为作者阐明相关机制提供了有力的病毒载体工具。
下面我们一起来看看作者是如何探索其中的机制:
作者首先研究了垂体单位在肿瘤免疫中的作用。为此构建了皮下移植瘤小鼠模型并检测了垂体激素的水平变化,皮下移植的细胞系包括免疫检查点疗法耐药的细胞系(LLC 肺癌细胞和 GMCSF 过表达的 B16F10 黑色素瘤细胞)和免疫检查点疗法敏感的细胞系(MC38 结肠癌细胞系和 MCA205 纤维肉瘤细胞)。结果发现,荷瘤小鼠模型血清中 α 促黑激素(α-MSH)的产生明显增加(图 1 A,B)。阿黑皮素原(POMC)经加工可产生 α-MSH,且正常情况下 POMC 主要在垂体中表达(图 1 C)。相比于对照组小鼠,荷瘤小鼠的垂体中叶中 POMC 表达增加(图 1 D,F)。同时发现,荷瘤小鼠的下丘脑室旁核神经元激活(图 1 F,G),而下丘脑可以调控垂体产生 α-MSH。此外,作者用 HBAAV2/9-Hspa9 shPOMC-GFP 敲低了小鼠脑下垂体 POMC 的表达,显著降低了荷瘤小鼠血清中 α-MSH 的水平(图 1 H, I)。这些结果表明荷瘤小鼠可以激活下丘脑并促进垂体产生 α-MSH。
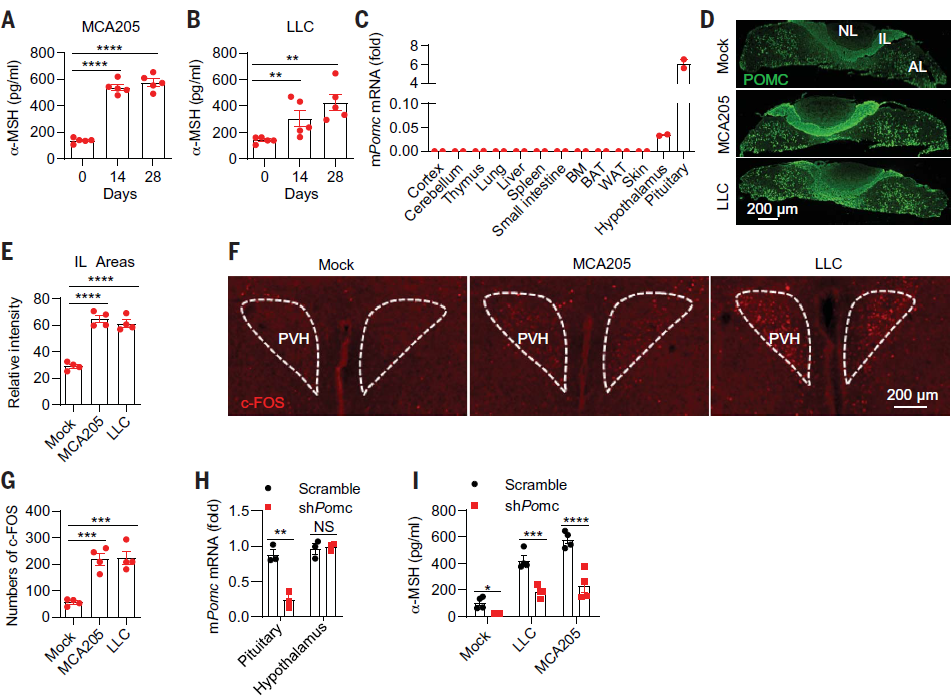
图 1. 荷瘤小鼠促进下丘脑的激活和垂体源性 α-MSH 的产生
接着,作者探讨了垂体来源的 α-MSH 在肿瘤生长中的作用。研究发现,抑制垂体中 POMC 的表达对荷瘤小鼠没有明显的毒性,并且抑制了 LLC 肿瘤的生长,同时增强了肿瘤中 CD8+T、CD4+T、NK 和 NKT 细胞的浸润,IFN-γ 也在这些免疫细胞中表达上调(图 2 A-D)。然而,补充 α-MSH 逆转了 POMC 的表达抑制对肿瘤生长和抗肿瘤免疫的影响。采用抗 CD4 和抗 CD8 抗体处理小鼠,耗尽肿瘤中 CD4+ 和 CD8+T 细胞,结果发现也消除了敲低 POMC 对肿瘤生长抑制的作用(图 2 E)。结果说明,抑制垂体中 POMC 的表达可通过增强抗肿瘤免疫来抑制肿瘤生长。
为了研究抑制 POMC 后如何增强抗肿瘤免疫,作者分析了 LLC 肿瘤中的肿瘤相关髓样细胞(TAMCs)的情况。结果发现,抑制 POMC 显著减少了肿瘤相关巨噬细胞(TAMs)、多核型骨髓源性抑制细胞(PMN-MDSCs)、单核 MDSCs(M-MDSCs)和树突状细胞(DC)的聚集(图 2 F)。同样,外源性补充 α-MSH 抵抗了 POMC 抑制所导致的荷瘤小鼠中 TAMCs 的扩增和骨髓生成受损(图 2 F,G)。上述结果表明,垂体产生的 α-MSH 可促进肿瘤诱导的骨髓生成。作者还进一步研究了 TAMCs 是否有助于 POMC 抑制诱导的肿瘤生长抑制。结果发现,在 LLC 肿瘤中耗尽 MDSCs 可延缓肿瘤的生长,而与耗尽 TAMs 无关,说明 MDSCs 是 LLC 肿瘤的主要 TAMCs(图 2 H)。此外,耗尽 MDSCs 的情况下,下调 POMC 并不能联合增强肿瘤抑制和抗肿瘤免疫。在 MC38 肿瘤中,TAMs 和 MDSCs 均能导致免疫抑制,当二者被耗尽时,也不能增强 POMC 下调所导致的 MC38 肿瘤生长抑制和抗肿瘤免疫(图 2 I)。以上结果表明,垂体来源的 α-MSH 可能通过骨髓生成来抑制抗肿瘤免疫。
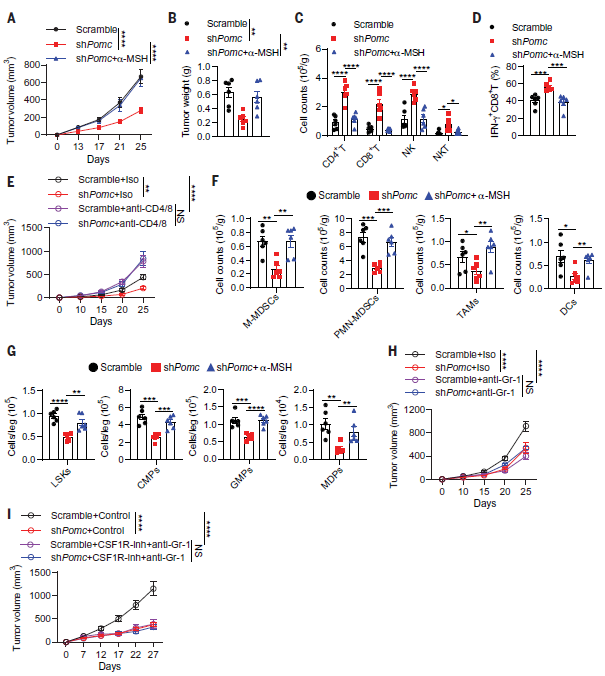
图 2. α-MSH 在肿瘤诱导的骨髓生成和免疫抑制中的作用
紧接着,作者探究了 α-MSH 促进骨髓生成的机制。通过检测介导 α-MSH 发挥功能的 MC1R 至 MC5R,发现只有 MC5R 在 Lin-BM 骨髓细胞中高表达,尤其是小鼠骨髓造血干细胞(Lin− cKit+ Sca1+ (LSK) 细胞)(图 3 A,B)。因此,认为 MC5R 与 α-MSH 促骨髓生成密切相关。为进一步验证这一结果,建立了 MC5R-/-小鼠模型。结果显示,MC5R-/- 小鼠中,移植 LLC 诱导 LSK 细胞增殖和髓系祖细胞 CMPS、GMPs 的扩增被抑制,TAMCs 的聚集减少(图 3 C,D)。可见 MC5R 在肿瘤诱导的骨髓生成中是必需的。与对照组小鼠相比,MC5R-/- 小鼠的 LLC、MCA205、MC38 或 B16F10-GMCSF 肿瘤的生长显著减少,并增强了抗肿瘤免疫(图3 E-I)。MC5Rfl/flVavcre 小鼠的实验结果与 MC5R-/- 小鼠模型相似(图 3 J)。此外,作者还发现当耗尽 T 细胞或骨髓间充质干细胞,可逆转 MC5R-/- 小鼠对肿瘤的抑制(图 3 K,L)。综上所述,α-MSH 通过 MC5R促进肿瘤诱导的骨髓生成和免疫抑制。
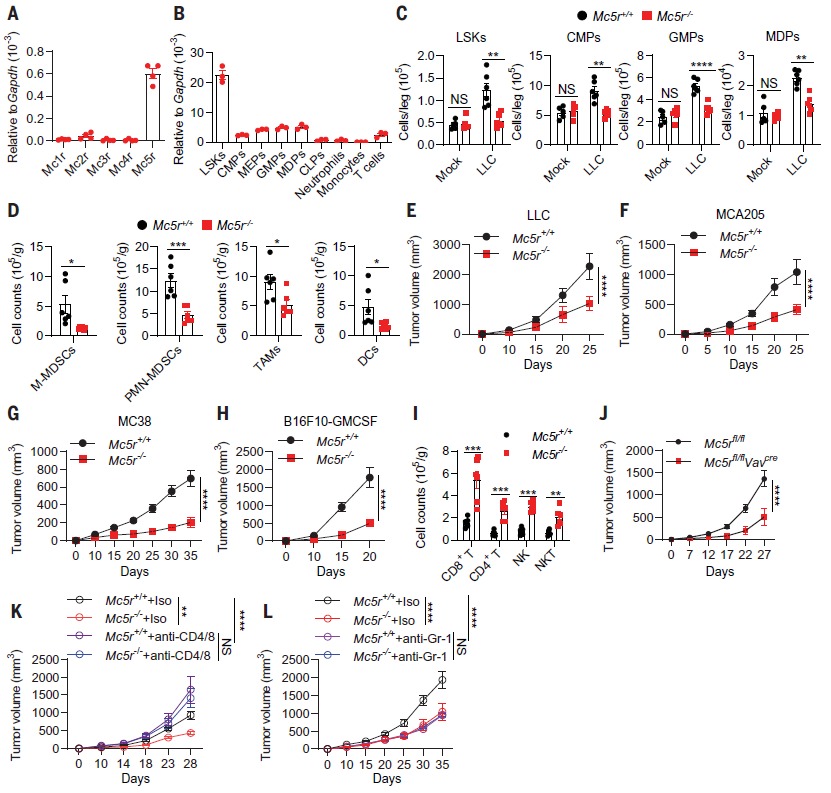
图 3. MC5R 在肿瘤诱导的骨髓生成和免疫抑制中的作用
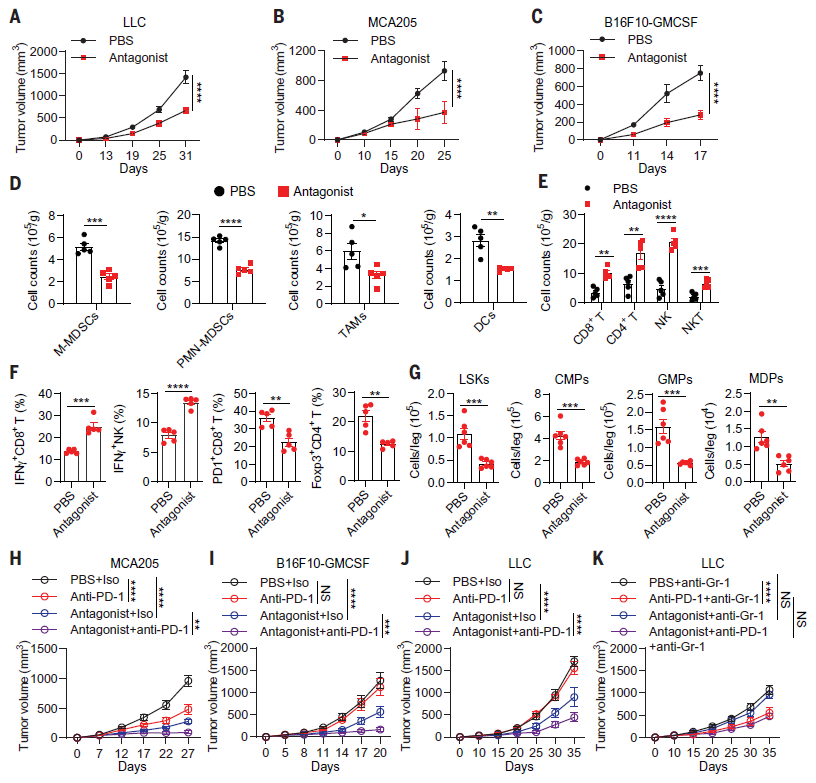
以上研究结果提示 MC5R 或许是治疗癌症的潜在靶点,为了探讨这一可能性,作者用 MC5R 特异性拮抗剂处理荷瘤小鼠。结果显示,MC5R 拮抗剂延缓了 MCA205 肿瘤、LLC 或 B16F10-GMCSF 肿瘤的生长(图 4 A-C),增强了抗肿瘤免疫,并抑制了 LLC 荷瘤小鼠的骨髓生成(图 4 D-G)。因此,这些结果表明,拮抗 MC5R 可以增强抗肿瘤免疫功能,具有潜在的抗肿瘤作用,即使在抗 PD-1 耐药的肿瘤中也是如此。
髓系细胞在限制 ICT 的疗效中起主要作用。因此作者进一步研究了抑制 MC5R 依赖的骨髓生成是否提高了 ICT 的效率或克服了 ICT 的耐药性。结果发现,在 MCA205、LLC 或 B16F10-GMCSF 荷瘤小鼠中,联合使用抗 PD-1 抗体和 MC5R 特异性拮抗剂对肿瘤的抑制作用要比二者单独使用要强得多(图 4 H-J)。另外,当耗尽 MDSCs 时,联合使用抗 PD-1 抗体和 MC5R 特异性拮抗剂未能抑制 LLC 肿瘤的生长(图 4 J,K)。结果表明,拮抗 MC5R 为提高 ICT 的效率或克服 ICT 耐药性提供了潜在的可能性。
 .
.
图 4. MC5R拮抗剂的免疫治疗作用
最后,作者探讨了 α-MSH-MC5R 轴与癌症患者的临床相关性。结果显示,MC5R 在人外周血单核细胞(PBMC)的造血干细胞中高表达(图 5 A)。非小细胞肺癌(NSCLC)患者血清中 α-MSH 的水平显著高于健康对照组,并且与 PBMC 中 PMN-MDSCs 或 M-MDSCs 的百分比呈正相关(图 5 B-D)。头颈癌(HNC)患者的检测结果与 NSCLC 患者相似,不同的是,HNC 患者中 α-MSH 水平升高与 M-MDSCs 无关(图 5 E-G)。以上结果表明,癌症患者血清中 α-MSH 水平增加,并于循环中的 MDSCs 有关。
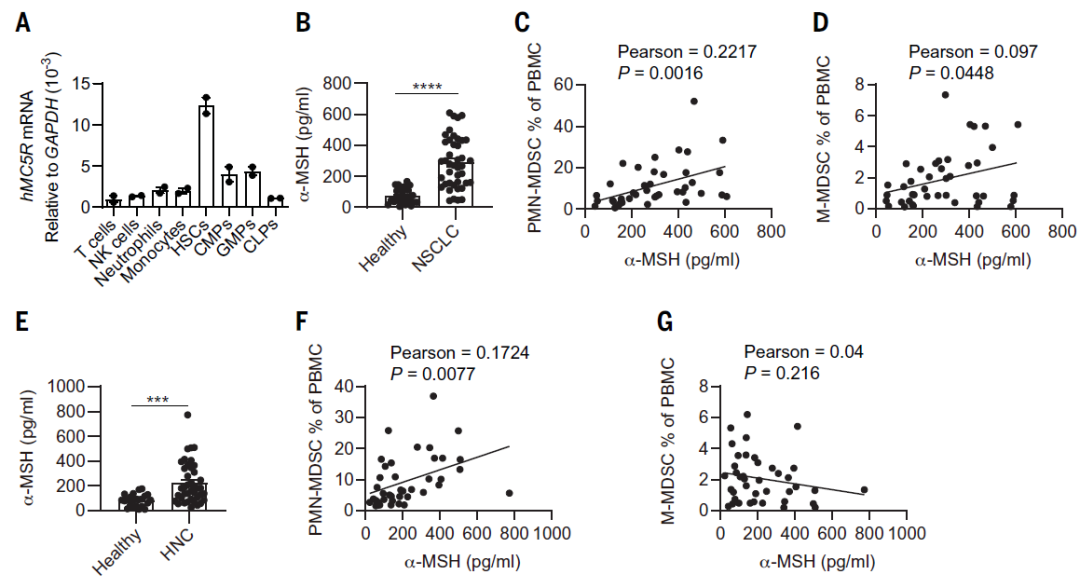
图 5. 癌症患者血清 α-MSH 浓度与外周血 MDSCs 百分比的相关性
综上所述,荷瘤小鼠可促进下丘脑的激活和垂体源性 α-MSH 的产生,然后作用于骨髓中的 LSK 细胞,通过激活 MC5R 信号促进骨髓生成和 TAMC 扩增。而 MC5R 特异性拮抗剂可以逆转肿瘤诱导的免疫抑制,且联合抗 PD-1 治疗时,可提高 ICT 的疗效或者抵抗 ICT 的耐药性。本研究阐明了下丘脑-垂体-骨髓这一神经内分泌途径促进肿瘤诱导的骨髓生成和免疫抑制的机制,并发现 MC5R 是有效的癌症免疫治疗靶点,尤其是对 ICT 耐药的癌症。
NAT COMMUN:银屑病治疗药物作用机制新发现
银屑病(Psoriasisis)是一种与免疫相关的慢性炎症疾病,因其皮损泛发,瘙痒、干燥显著,易复发,无法根治,给患者带来了极大的心理压力,严重影响患者的生存质量。角质形成细胞中丝苏氨酸蛋白磷酸酶 -6(PP6)的表达失衡是银屑病炎症的主要原因,平衡角质形成细胞中 PP6 的表达有望成为治疗银屑病的全新策略。
2022 年 12 月 19 日上海交通大学医学院的王宏林教授和他的团队在nature communications上发表了题为「Targeting the transcription factor Hes1 by L-menthol restores protein phosphatase 6 in keratinocytes in models of psoriasis」的研究论文,该研究发现L-薄荷醇能够通过靶向结合 Hes1 促进角质形成细胞中PP6的表达进而改善银屑病样皮肤炎症。
值得注意的是,在本研究中,作者使用了汉恒生物提供的腺病毒(Ad)和腺相关病毒(AAV9),成功在体内和体外实现了 PP6、Hes1 的敲低和过表达。
接下来我们看看文章的研究结果:
在本研究中,作者发现银屑病患者皮肤中 PP6 的表达显著高于正常对照,作者用 Ad-shPP6 腺病毒敲低 HaCaT 细胞中 PP6 后,通过 3D 培养,发现 PP6 的敲低能促进细胞表皮增生。
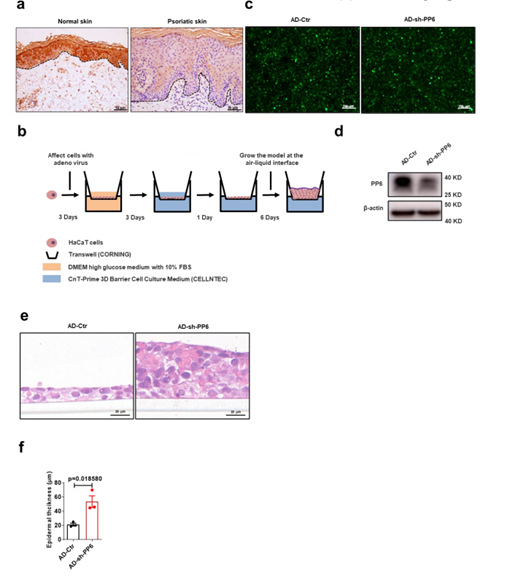
图 1 角质形成细胞中 PP6 的下调增加了皮肤的表皮厚度
接着,作者利用化合物库 Tsbiochem 筛选到化合物 L- 薄荷醇能显著提高 HaCaT 中 PP6的蛋白水平,但有趣的是,它并不影响细胞的活力和 PP6 的 mRNA 水平。作者利用体内实验探讨了 L- 薄荷醇对银屑病的治疗作用,发现与对照组相比,L- 薄荷醇减轻了小鼠耳朵的炎症表型(红斑、厚度和脱屑),同时减少了损伤皮肤的表皮厚度、细胞浸润、炎症因子和 Ki67 的表达;此外,局部应用 L- 薄荷醇可显著提高表皮中 PP6 蛋白水平。
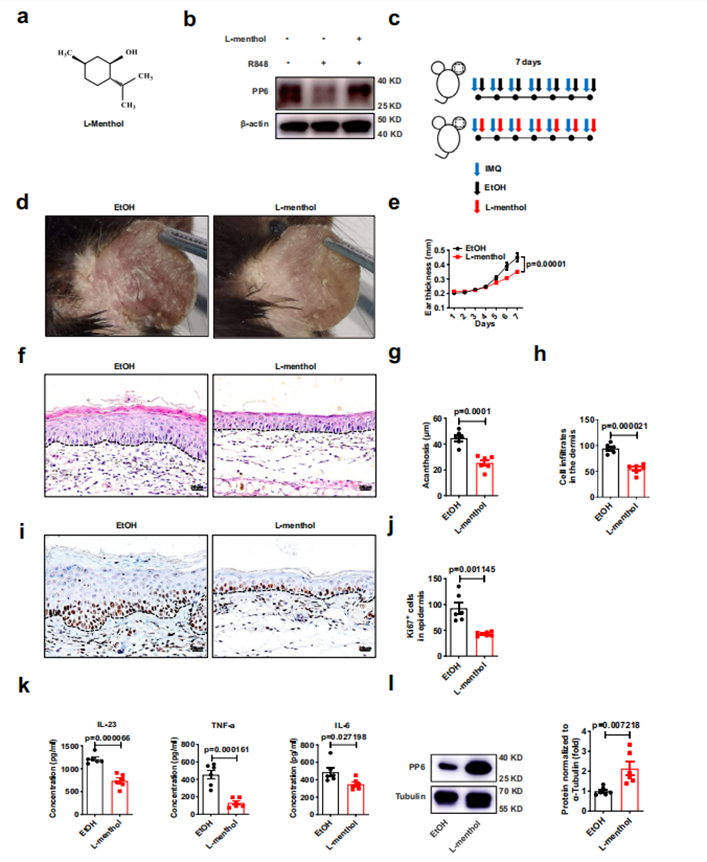
图 2 L- 薄荷醇上调炎性角质形成细胞中 PP6 的表达,减轻 IMQ 诱导的皮肤炎症
为了进一步探讨 L- 薄荷醇对银屑病的治疗作用是否依赖于 PP6,作者使用 PP6 基因敲除小鼠 K5. Pp6fl/fl 和正常小鼠 Pp6fl/fl 作为研究工具;发现 L- 薄荷醇对 Pp6fl/fl 银屑病小鼠表型有显著改善(表皮厚度、皮肤浸润以及 Ki67 的表达显著下降),并且促进 PP6 的表达,而对于 K5.Pp6fl/fl 银屑病小鼠则不能带来相应改变。
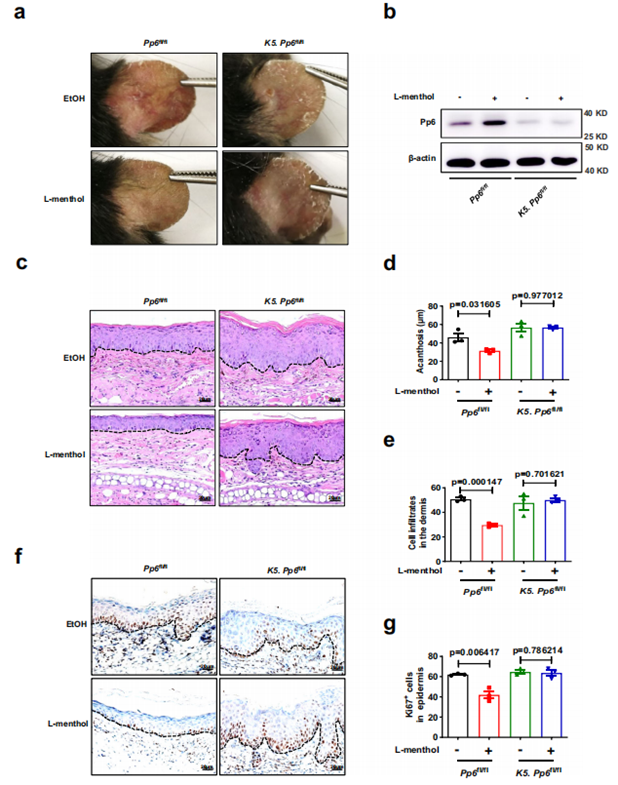
图 3 L- 薄荷醇在角质形成细胞中的抗炎作用依赖于 PP6
接着,作者通过 DARTS 技术联合无标记质谱法筛选到 L- 薄荷醇的靶蛋白 Hes1,并且在 HaCaT 和小鼠原代角质形成细胞中验证了两者的作用;此外,借助微量热泳动仪(MST)获得了 L- 薄荷醇与 Hes1 间的解离常数。通过单细胞测序(scRNA-seq)发现 Hes1 主要在角质形成细胞中表达,并且,银屑病患者角质形成细胞以及表皮中 Hes1 的表达显著低于对照组。作者随后构建了体内、体外银屑病模型,用 L- 薄荷醇处理,出现了类似于 PP6 的结果,即 L- 薄荷醇能促进角质形成细胞中 Hes1 蛋白的表达,但不影响其转录。进一步研究发现,L- 薄荷醇能够通过抑制蛋白酶体对 Hes1 蛋白的降解进而增加 Hes1 蛋白的水平。
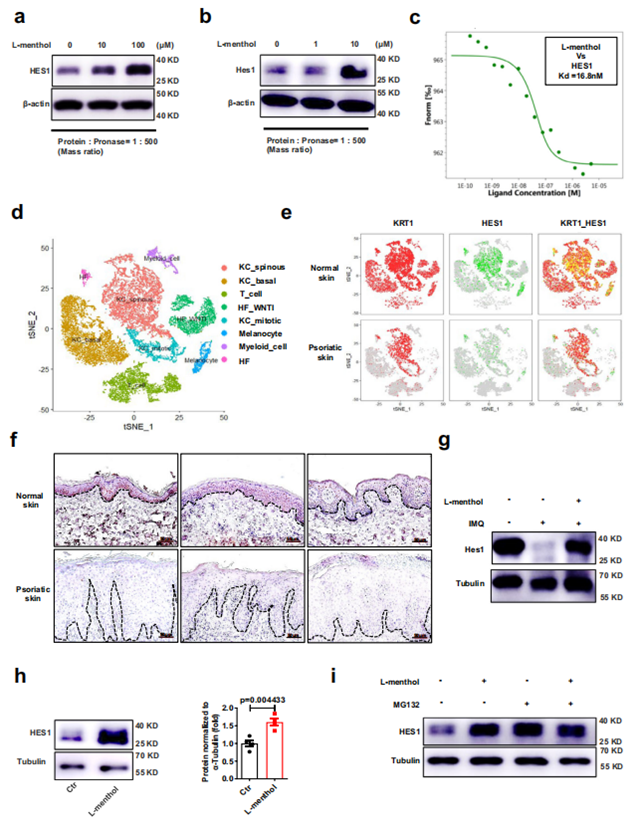
图 4 L- 薄荷醇靶向角质形成细胞中的 Hes1 并且上调其表达
作者使用 K5. Hes1fl/fl 和 Hes1fl/fl 小鼠作为研究工具,发现表皮细胞缺失 Hes1 能加重 IMQ 诱导的小鼠银屑病表型,即 K5. Hes1fl/fl 小鼠表皮厚度、细胞浸润以及损伤表皮细胞中 Ki67 的表达显著增加,与 Hes1fl/fl 银屑病模型小鼠相比,K5. Hes1fl/fl 银屑病模型小鼠表皮中 PP6 的蛋白水平更低,但是 mRNA 水平没有差异。同样,在 HaCaT 细胞中干扰 Hes1 后,PP6 的蛋白水平降低,但 PP6 mRNA 水平并不改变。作者利用 Ad-shHes1 在 NHEK 细胞中敲低 Hes1 的表达后,显著促进了 NHEK 细胞的异常增殖。另外,在动物水平上,与 PP6 的研究结果类似, L- 薄荷醇可以显著改善 Hes1fl/fl 银屑病小鼠表型(表皮厚度、皮肤浸润以及 Ki67 的表达显著下降),并且促进 PP6 的蛋白表达;L- 薄荷醇处理的 K5.Hes1fl/fl 银屑病小鼠表皮厚度、皮肤浸润以及 Ki67 的表达均未发生变化。
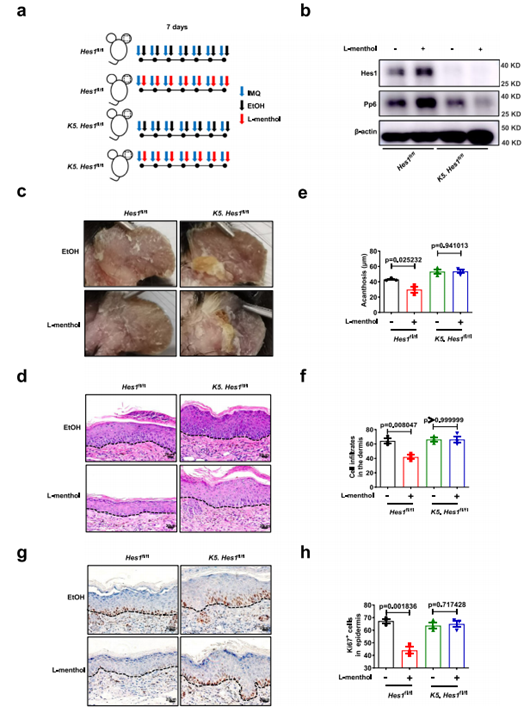
图 5 L- 薄荷醇在角质形成细胞中调控PP6的表达依赖于 Hes1
前期的研究表明 Hes1 表达失衡只能改变 PP6 的蛋白水平而不影响其转录,为探究其原因,作者利用 CO-IP-MS 筛选到 PP6 的互作蛋白 IGBP1,但并没有发现 Hes1 与 PP6 直接结合。作者以 Hes1f1/f1 小鼠和K5.Hes1f1/f1 小鼠为研究对象,发现 L- 薄荷醇只能上调 Hes1f1/f1 小鼠表皮中 Hes1和Igbp1 的表达,而不影响 K5.Hes1f1/f1 小鼠表皮中 Hes1 和 Igbp1 的表达;并且,K5.Hes1f1/f1 银屑病小鼠表皮中 Igbp1 的 mRNA 水平显著低于 Hes1f1/f1 银屑病小鼠,作者通过双荧光素酶实验证实了 HES1 通过与 IGBP1 的启动子结合激活 IGBP1 的转录。接着,作者利用 AAV9-Hes1 在银屑病小鼠体内过表达 HES1,发现过表达 HES1 明显改善了银屑病小鼠的表型(表皮厚度,真皮细胞浸润和表皮Ki67表达显著降低)。此外,在银屑病 HaCat 细胞模型和动物模型中过表达 HES1 均能上调 IGBP1 和 PP6 的蛋白水平。
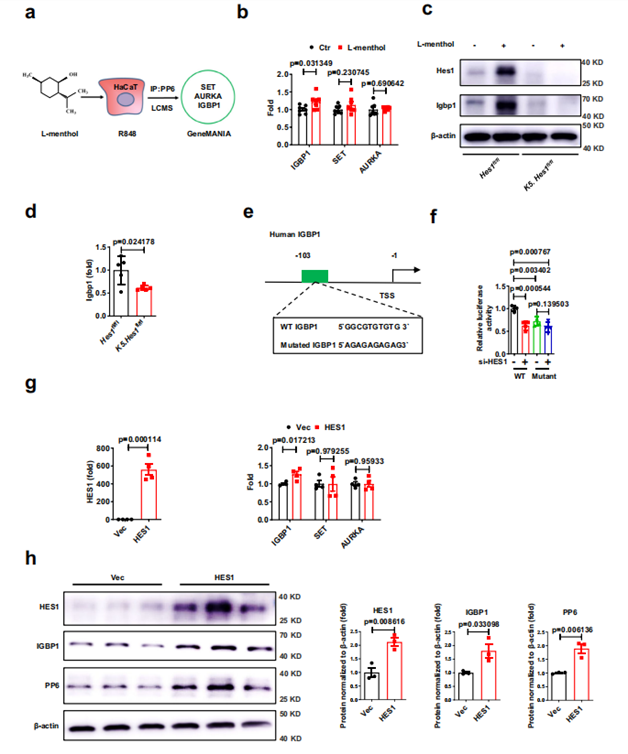
图 6 HES1 转录激活 IGBP1 的表达
最后,作者利用 rescue 实验进一步研究发现在 HaCaT 细胞中过表达 IGBP1 能够逆转由 HES1 敲低导致的 PP6 下调表达;此外,在角质形成细胞中干扰 Igbp1 能显著降低 PP6 的表达,并且,IGBP1 的下调促进 PP6 的泛素化;相反,过表达 Igbp1,能显著增加 PP6 的表达并减少 PP6 的泛素化。
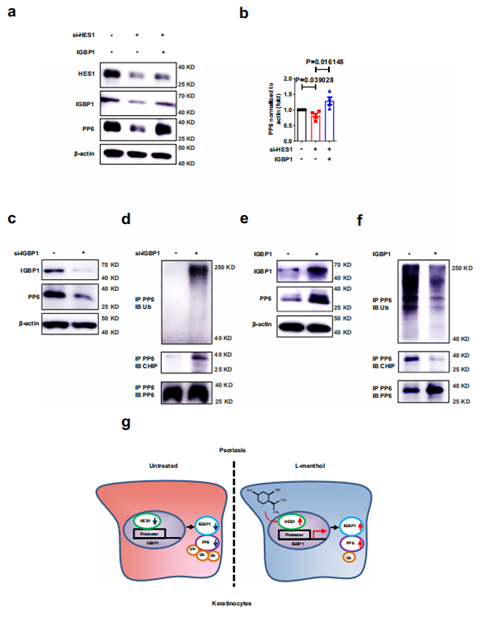
图 7 IGBP1 促进角质形成细胞中 PP6 的表达
综上所述,L- 薄荷醇能通过靶向结合 Hes1 激活 Igbp1 转录,Igbp1 通过抑制 E3 泛素连接酶与 PP6 的结合来抑制其泛素化,从而促进 PP6 在角质形成细胞中的表达。本研究阐述了 L- 薄荷醇治疗银屑病的作用机制,为银屑病的治疗提供了潜在的治疗靶点。
Acta Pharmaceutica Sinica B|揭秘小檗碱BBR抗炎作用新靶标—EIF2AK2
中药作为民族瑰宝,已应用了数千年。揭示中药单体的作用靶点和作用机制,可大大提高新药的发现速度和中药的接受程度。小檗碱(BBR),与二甲双胍、阿司匹林等被并称为「神药」,药理活性广泛。除传统的抗痢疾杆菌活性外,小檗碱在 II 型糖尿病、高脂血症、阿尔兹海默症等方面的新生物学作用逐渐被发现和阐明。基于此,BBR 的直接靶标陆续被发现,但其复杂而巧妙的网络机制尚未完全阐明,如果能阐明 BBR 的关键靶点,不仅有助于我们理解生物进化的本质,也能为新药的发现提供「可成药」 的靶点。
2022 年 12 月 14 日,中国医学科学院医药生物技术研究所宋丹青团队在《Acta Pharmaceutica Sinica B》(IF=14.903)发表了题为:「Discovery and identification of EIF2AK2 as a direct key target of berberine for anti-inflammatory effects」的研究论文,该团队使用全新的 BBR 二苯酮光亲和探针,通过基于活性的蛋白质组分析技术(ABPP)寻找抗炎的关键靶点。他们首先通过多学科交叉的手段,首次发现并验证 EIF2AK2(也称为 PKR)、eEF1A1、PRDX3 和 VPS4B 作为 BBR 的直接靶点,发挥协同抗炎作用。其中,BBR 通过离子键与 EIF2AK2 强结合,并通过 EIF2AK2 同时调控多种炎症通路,表明 EIF2AK2 是 BBR 抗炎作用的关键靶标。此外,BBR 可以巧妙地抑制 EIF2AK2 二聚体形成而不是直接抑制其酶活性,并选择性抑制 JNK、NF-κB、AKT 和 NLRP3 等多种信号通路,具有良好的安全性。体内研究进一步证实,BBR 以 EIF2AK2 依赖性方式抑制炎症反应,因此,抑制 EIF2AK2 二聚体形成可能成为治疗炎症等相关疾病的重要靶点。值得注意的是,本研究使用了汉恒生物提供的敲低 EIF2KA2 的腺相关病毒(AAV)。
下面,我们一起来看具体的研究结果:
首先,作者在 THP-1 细胞中筛选并评估了 BBR 靶标的荧光标记,最终选择了 11b 作为功能性探针,通过生信分析以及 11b 探针下拉实验表明,EIF2AK2、eEF1A1、PRDX3 和 VPS4B 这 4 种蛋白为 BBR 的潜在直接靶蛋白。
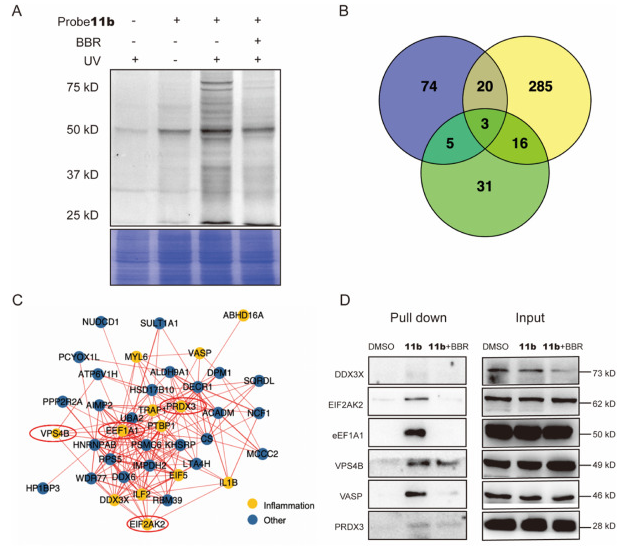
图 1. 靶蛋白捕获和功能分析
然后,作者用 CETSA 实验验证 BBR 与 4 种靶蛋白的相互作用,发现添加温度为 35~75℃之间的 BBR,四种蛋白的热稳定性均有不同程度的增强,表明 BBR 与这四种蛋白质之间可能存在直接相互作用。作者用 SPR 分析并使用软件对 BBR 与 4 种蛋白进行分子对接,再次验证了 BBR 与这四种靶蛋白之间的特异性相互作用,而 EIF2AK2 与 BBR 的亲和力最强。
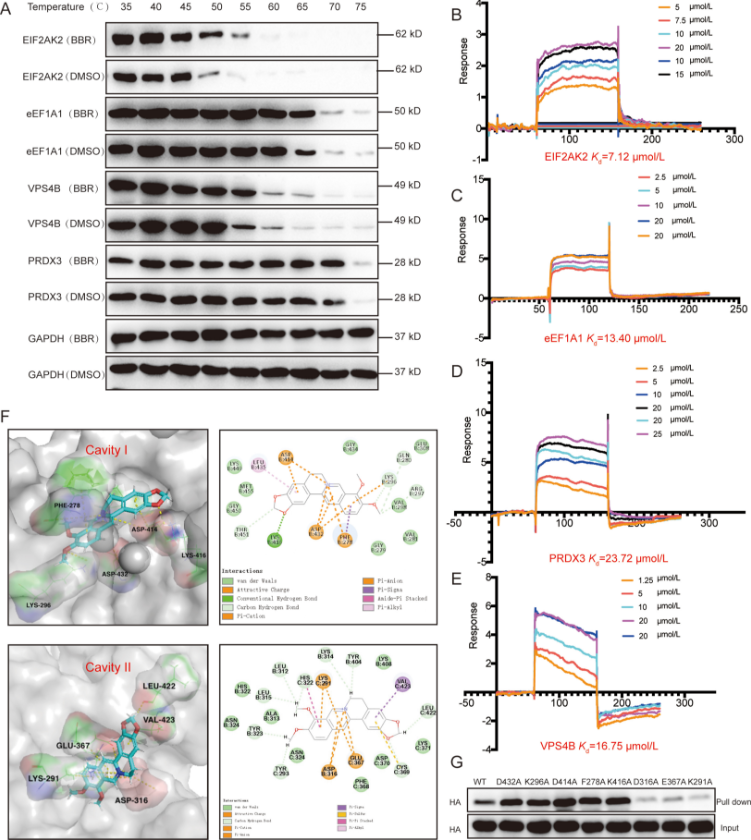
图 2.BBR 与其潜在靶标之间的亲和力研究
由于 EIF2AK2 可以调节多种信号转导途径,并参与多种炎症相关疾病的调控,因此作者对 EIF2AK2 与 BBR 的相互作用模式和抗炎功能进行了深入研究。基于 EIF2AK2 与 BBR 之间的强亲和力,作者推测它们之间可能存在离子键,故选择了两个含有不同离子键相互作用的空腔,使用软件进行分子对接并结合氨基酸单点突变进行免疫印迹分析,结果表明,BBR 可能直接靶向 EIF2AK2 的二聚化以调节抗炎作用。作者接着用免疫沉淀的方法进一步验证了 BBR 确实干扰 EIF2AK2 二聚化。直接靶向 EIF2AK2 二聚化或自磷酸化可能会导致不同的下游效应,为了进一步了解这种差异,作者用 EIF2AK2 自磷酸化抑制剂 C16 来测定 EIF2AK2 的抑制活性,结果表明,BBR 可以通过靶向 EIF2AK2 二聚反应选择性地发挥相关活性来避免可能的毒性,说明 BBR 具有良好的安全性。
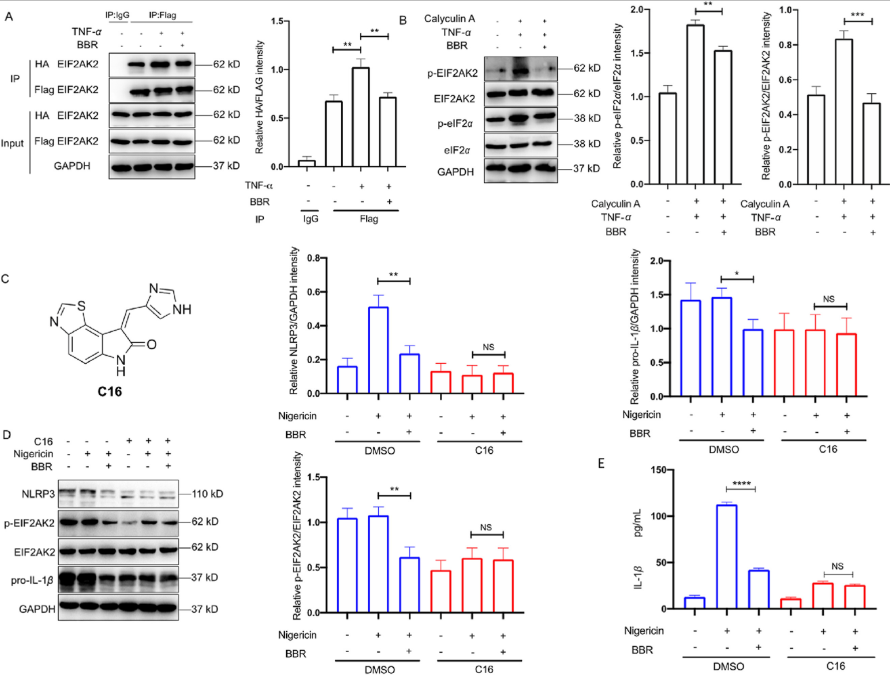
图 3.EIF2AK2 的功能研究
为了进一步了解 EIF2AK2 的功能作用,作者通过测量 PMA-THP-1 细胞中的 IL-1β释放来验证 NLRP3 炎症小体的功能,结果发现 BBR 可能通过作用于 EIF2AK2 来抑制 NLRP3 表达和 IL-1β的释放。由于 EIF2AK2 在脑组织中表达相对较高,作者进一步验证了 EIF2AK2 与人源性小胶质细胞炎症通路之间的相关性,正如预期,BBR 可下调 LPS 诱导的 p-NF-κB p65 和 p-JNK 的升高,而 BBR 抑制 p-NF-κB p65 和 p-JNK 的作用在 EIF2AK2 被敲低后部分或完全丧失。但当 EIF2AK2 过表达时,p-NF-κB p65 和 p-JNK 的 BBR 依赖性抑制被逆转。以上结果表明 BBR 可通过靶向 EIF2AK2 来影响脑炎症反应,并揭示了 BBR 在大脑中发挥抗炎作用的可能机制。此外,BBR 可以抑制棕榈酸(PA)诱导的 p-JNK 水平上升,并上调 HepG2 细胞中 SIRT1 蛋白的表达,其中 SIRT1 是与脂质代谢密切相关的重要生物标志物,结果进一步表明,BBR 可能通过与关键蛋白 EIF2AK2 结合来调节炎症诱导的脂质代谢紊乱。
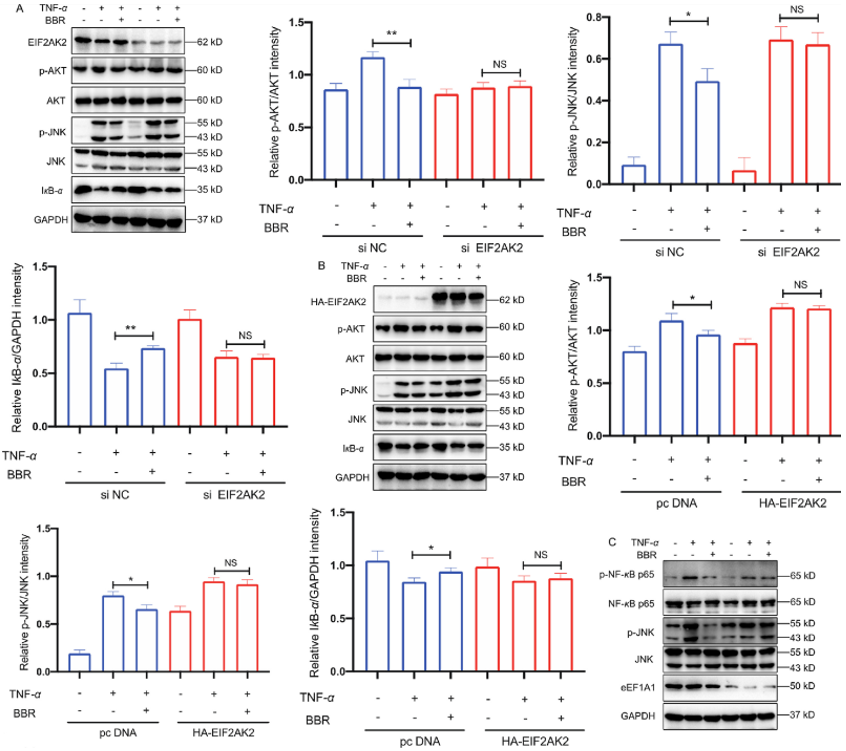
图 4.BBR 靶点的功能研究
此外,作者选择了 4 个 BBR 靶标的经典验证相关途径进行功能验证,作者建立了这 4 种蛋白质在细胞水平上的过表达或敲低模型,以研究 BBR 是否以依赖性方式调节不同的经典炎症途径,如 JNK,NF-κB,MAPK 和 AKT 信号。通过一系列 WB 实验表明,BBR 分别通过 EIF2AK2、eEF1A1、PRDX3 和 VPS4B 依赖方式调节 JNK、NF-κB、MAPK 和 AKT 等多种信号通路,其中 EIF2AK2 起主导作用,随后,作者进行了体内实验来进一步确认。
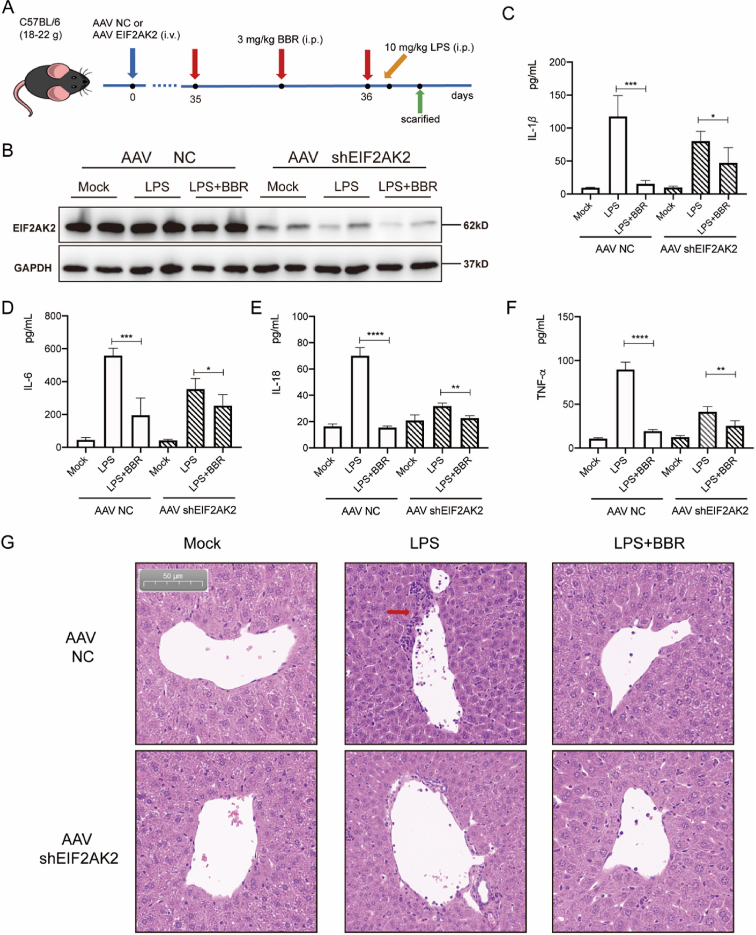
图 5.EIF2AK2 体内功能验证
由于 IL-1β、IL-6、IL-18 和 TNF-α的分泌与炎症小体 NLRP3 的表达、JNK 和 NF-κB 通路的激活等密切相关,作者进一步论证了 BBR 是否通过靶向 EIF2AK2 来影响 IL-1β、IL-6、IL-18 和 TNF-α的体内释放。通过小鼠尾静脉注射腺相关病毒 AAV-shEIF2KA2-GFP 成功建立了 EIF2KA2 敲低小鼠模型,以评估 BBR 对 IL-1β、IL-6、IL-18 和 TNF-α的影响。结果显示,BBR 显著降低了对照组 IL-1β、IL-6、IL-18 和 TNF-α的产生,而 BBR 的作用在 EIF2AK2 敲低组中减弱,肝脏的 H&E 染色结果表明,BBR 可减轻 EIF2AK2 敲低小鼠的肝脏组织的炎症浸润。简言之,BBR 可能通过靶向 EIF2AK2 下调 IL-1β、IL-6、IL-18 和 TNF-α的分泌,具有良好的安全性。
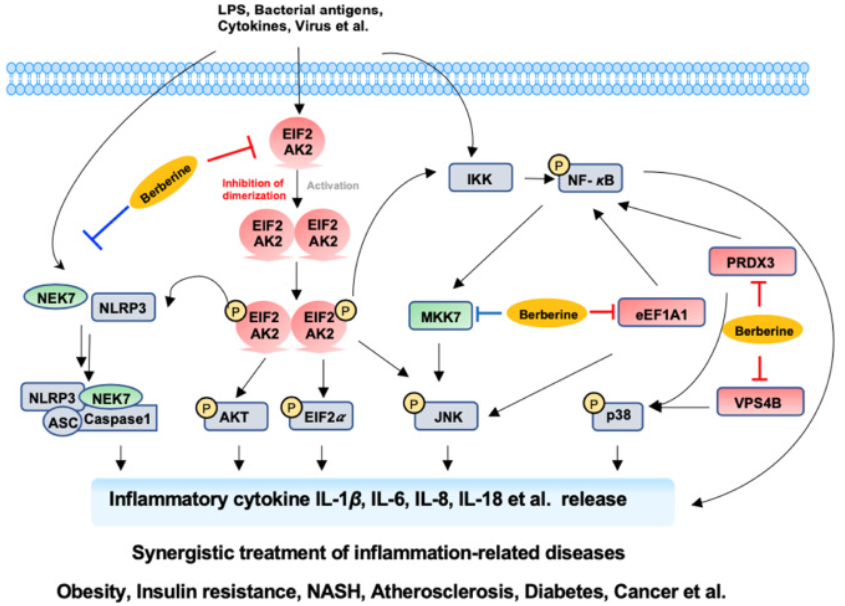
图 6.BBR 抗炎机制图
综上所述,作者确定了 EIF2AK2 可调节多种信号转导通路,包括 AKT、JNK 和 NF-κB 通路。同时,四个新确定的 BBR 抗炎作用的直接靶标(eEF1A1,PRDX3 和 VPS4B,EIF2AK2)是治疗几种炎症相关疾病的关键靶点,由于 BBR 通过多靶点网络机制发挥其多样化的药理活性,因此需要进一步探索更直接的靶点,明确每个靶点的贡献,以充分阐明复杂而巧妙的基因间的网络机制以及相应的生物学效应。此外,BBR 能直接抑制 EIF2AK2 的二聚化,发挥协同抗炎作用,具有良好的安全性,因此,抑制 EIF2AK2 二聚化可能是炎症相关疾病的重要治疗靶点。
![[精选]SCI论文写作投稿资料包:100+资料& 投稿答疑30问](https://img1.dxycdn.com/p/s14/2023/1105/569/6102685706544601271.jpg!wh200)