Theranostics | 空间代谢组学方法评估抗癌药物肿瘤靶向效率和瘤内分布异质性
鹿明生物
癌症治疗研究中的关键问题是可区分正常组织和肿瘤组织的靶向抗肿瘤药物开发在新药研发的早期,如何快速评估抗癌药物的肿瘤靶向性非常重要,且了解药物在肿瘤内的异质性分布更具挑战。开发一种高精度、高灵敏度的定量成像分析方法有望解决这一难题。开发一种高精度、高灵敏度的定量成像分析方法有望解决这一难题。质谱成像是一种无需标记的分子成像技术,它可提供有关生物体内药物和代谢物分布的时空信息,其在药物开发领域的应用正在迅速增加。
中国医学科学院药物研究所天然药物活性物质与功能国家重点实验室贺玖明团队在《Theranostics》期刊发表的题为“Evaluation of the tumor-targeting efficiency and intratumor heterogeneity of anticancer drugs using quantitative mass spectrometry imaging”的研究成果,采用空气动力辅助解吸电喷雾离子化(AFADESI)技术和基于人工神经网络(ANN)的虚拟校正-定量质谱成像(VC-QMSI)方法,建立了针对紫杉醇及其衍生物前药的体内定量成像方法,为评估该类药物的肿瘤靶向效率和瘤内异质性分布提供了直观有效的途径,也为靶向抗肿瘤新药研发提供了有力的研究工具。
实验设计:
本文通过构建含已知浓度药物的模拟生物组织,建立了定量质谱成像标准曲线;采用空气动力辅助解吸电喷雾离子化质谱成像(AFADESI-MSI)技术,同时采集药物、药物代谢物和内源性代谢物信息;以内源性代谢物为内标,结合 ANN 方法,构建了生物组织中质谱响应基体效应自动预测与校正的回归模型,对动物切片的单位像素进行逐一定量,从而建立了整体动物体内药物质谱成像分析方法。将该方法用于评估静脉注射紫杉醇(PTX)、紫杉醇脂质体(PTX-liposome)和紫杉醇前药(PTX-R)在 A549 细胞异种移植裸鼠中的靶向效率和瘤内的分布异质性。
研究看点:
基于人工神经网络的虚拟校正-定量质谱成像策略,该策略的步骤如下:作者采用含有相同药量的不同类型的模拟组织,筛选出与药物响应强度变化紧密相关的内源性代谢物,并建立药物的相对响应强度(相对校正因子 RCF)与内源性代谢物离子强度之间的 ANN 模型。
接着作者探究 PTX 在整体动物中的时空分布,PTX 组和 PTX-liposome 组:PTX 在动物体内呈广泛分布,在心、肝、脾、肺、肾、肌肉、肠、胃和肿瘤组织中均有分布;在健康组织中的含量远高于 PTX-R 组;给药后期可观察到 PTX 在胃肠道中大量积累,而在肾组织中几乎不见,提示PTX可能主要通过胆汁-粪便途径排泄。PTX-R 组:与前两组的广泛分布不同,PTX-R 主要分布于肿瘤组织,其次是肺和肠。三组小鼠脑中均没有明显的药物分布。就 24h 内的肿瘤组织药物暴露量而言,PTX-R 组与 PTX-liposome 组相当,是 PTX 组的 2 倍;以 PTX 组为参比,PTX-R 组的相对靶向效率(RTE)是 PTX-liposome 组的近 50 倍。以上证明 PTX-R 有良好的肿瘤靶向能力。
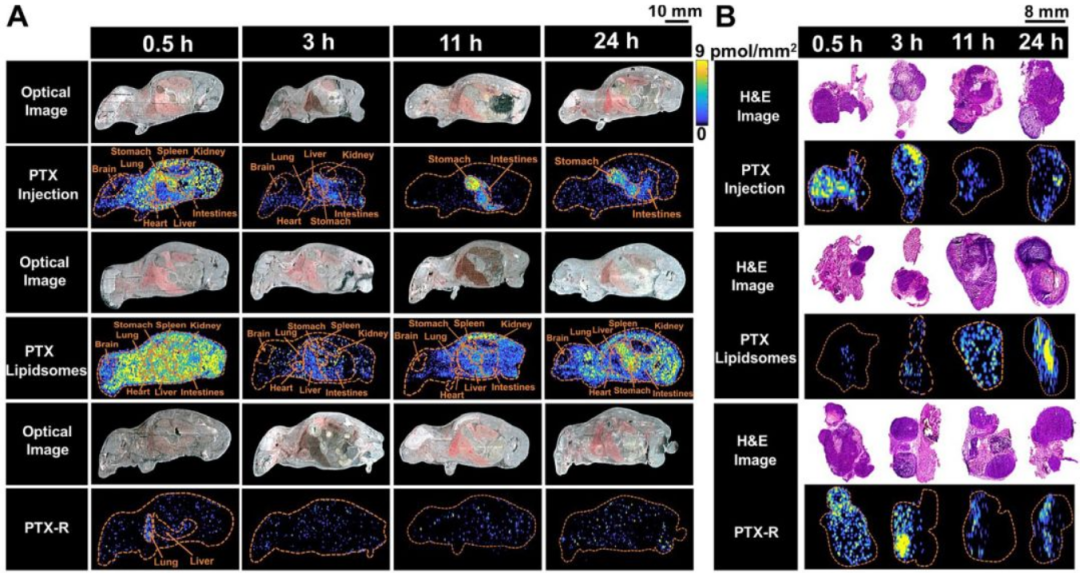
图 2 | 三个给药组在不同时间点的 AFADESI-MSI 可视图
接着作者探究 PTX-R 的瘤内异质分布,肿瘤根据形态学的异质性可分为不同的微区(图 3A,3B)。基于代谢物特征采用 t-SNE 和 k-means 等手段得到的肿瘤微区自动识别的结果(图 3C)与 H&E 染色结果(图 3A)高度一致。PTX-R 在肿瘤坏死区域和胶原蛋白区域的含量明显高于肿瘤薄壁组织区域(图 3D,3E, 3F),表明 PTX-R 具有出色的肿瘤穿透能力。对比肿瘤的薄壁组织和间质区域,PTX-R 更多地积累于肿瘤中未明显分化的区域,比如肿瘤的胶原蛋白区域和脂肪组织。这种药物在肿瘤微区分布的异质性值得进一步研究,它对于认识肿瘤的生长、侵袭、对药物的敏感性以及预后均有重要作用。
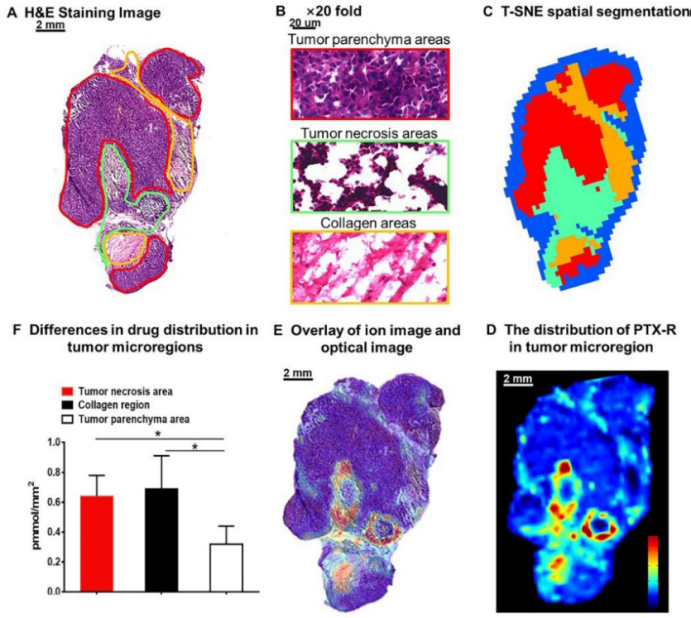
图 | PTX-R 在瘤内的异质分布
本文采用无需标记的 AFADESI 和 VC-QMSI 技术成功建立了针对紫杉醇及其前药的定量质谱成像方法,评估了该类抗肿瘤药物的肿瘤靶向效率和瘤内分布异质性,并提供了直观的实验证据表明设计的紫杉醇前药具备优异的肿瘤蓄积能力和低全身毒性。进一步证明 AFADESI-MSI 技术具有高灵敏和宽覆盖的特点,可在整体动物的体内微区同时可视化各种类型的药物、代谢物和内源性代谢物。 VC-QMSI 方法将内源性代谢物作为内标,建立 ANN 模型;根据模型预测每个像素的 RCF 值,并校正药物离子强度,从而实现药物在整体动物和亚器官组织中的定量可视化。紫杉醇前药及其代谢物的体内定量分布研究有助于从药物的保留、消除、靶向和释放四个角度设计有效的肿瘤靶向药物。所建方法有助于预测与药物分布相关的药效和安全性,在抗肿瘤药物研发早期进行直接快速的药效筛查,减少损耗、降低成本。此外,本研究对阐明药物的功效、毒性和耐药性提供了一个深入的视角,有助于抗肿瘤药物的设计和优化。