简介
附睾精子评估实验包括:① 血细胞计数板计数整个附睾的精子数目;② 附睾精子涂片;③ CASA 仪器检测附睾尾部精子的各项运动指标;④ CTC 精子染色。
材料与仪器
步骤
附睾精子评估实验的基本过程可分为如下几步:
(一)血细胞计数板计数附睾精子总数操作步骤:
A 解剖 12 周龄实验组和对照组雄性小鼠各 12 只,把分离出的附睾置于 1 mL 的 M2 培养液中剪碎,37 ℃ 孵育 30 分钟,以便精子在培养液中得以释放。
B 取一滴精子悬液滴在血细胞计数板上,按照血细胞计数法测定精子悬液中的精子密度,换算为每个附睾中的精子总数,试验用相衬光学倒置显微镜观察。计数 3 次,取平均值。
C 实验完毕后,用 SPSS13.0 软件分析实验结果。
(二)附睾精子涂片观测精子形态操作步骤:
A 解剖 12 周龄实验组和对照组雄性小鼠各 12 只,把分离出的附睾置于 1 mL 的 M2 培养液中剪碎,37 ℃ 孵育 30 分钟,以便精子在培养液中得以释放。
B 另外,吸取上述精子悬液 30 μL 滴在载玻片上,用盖玻片与载玻片呈 45° 夹角迅速推膜,制成精液涂片,然后水平放置精液涂片 10 分钟。
C 晾干后浸入 95% 乙醇与甲醇混合液中固定 2~3 分钟,取出后再次晾干。
D 常规 HE 染色后,用磷酸缓冲液(磷酸二氢钾 6.63 g,磷酸氢二钠 2.56 g,加蒸馏水至 1 L)或蒸馏水轻轻冲洗精液涂片,并不时镜检调色,至颜色合适为止,相差显微镜及高倍显微镜下观察精子形态。
(三)CASA 分析附睾尾部精子各项运动指标操作步骤:
A 将胎牛血清 FBS 和 mHTF 按体积比 1:9 制成混合液,调节 pH 至 7.8。
B 解剖 12 周龄实验组和对照组雄性小鼠各 12 只,取附睾尾部精子,加入上述 FBS/mHTF 混合液 500 μL,37 ℃,5 分钟。
C 取 10 μL 样品,用 CASA 检测分析附睾精子轨迹速度(VCL)、平均路径速度(VAP)、直线运动速度(VSL)、直线性(LIN)、精子侧摆幅度(ALH)、前向性(STR)、摆动性(WOB)、鞭打频率(BCF)、平均移动角度(MAD)、运动精子密度等相关指标,记录数据。
D 实验完毕后,用 SPSS13.0 软件分析实验结果。
(四)附睾尾部 CTC 精子染色操作步骤:
A 将胎牛血清 FBS 和 mHTF 按体积比 1:9 制成混合液,调节 pH 至 7.8。
B 解剖 12 周龄实验组和对照组雄性小鼠各 12 只,取附睾尾部精子,加入上述 FBS/mHTF 混合液 500 uL,37 ℃,5 分钟。
C 配 CTC 染液:TN 混合液 10 mL、半胱氨酸 8.8 mg、CTC 1.3 mg 混匀振荡溶解后,用 NaOH 调节 pH 至 7.4。4 ℃ 避光保存。
D 配固定液:Tris 3.02 g 溶于 10 mL PBS,10% 甲醛 1 mL 溶于 9 mL PBS,混匀,4℃ 避光保存。
E 吸取 50 μL 精子悬液加入 50 μL CTC 染色液,反应 30 秒后,马上加入 17.5 μL 固定液轻微吹打均匀后,37 ℃ 条件下用 5% CO2 孵育 1 小时。
F 4 ℃ 冰箱沉降过夜。
G 次日弃少许上清后吹打均匀,涂载玻片,晾干后 DABCO 封片,荧光显微镜蓝光激发观察。
H 实验完毕后,用 SPSS13.0 软件分析实验结果。
注意事项
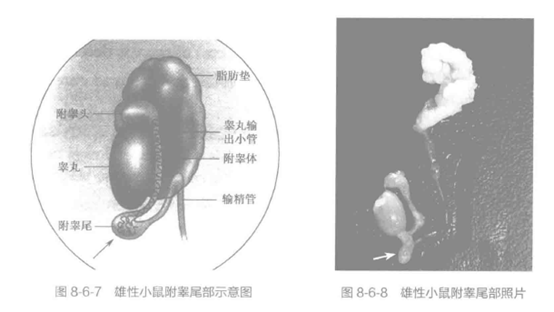
1 附睾精子评估一般选用 12 周龄小鼠,实验组和对照组各 12 只。注意:血细胞计数法计数附睾尾部精子和附睾精子涂片通常取整个附睾,而用 CASA 仪分析附睾尾部精子各项运动指标以及 CTC 精子染色所用的往往是附睾尾部的精子,而不是整个附睾部的精子。见图 8-6-7(箭头所指处即附睾尾部)及图 8-6-8(箭头所指处即附睾尾部)。
来源:丁香实验







