Cell Metab:浙大吕志民团队揭示肿瘤细胞 Warburg 效应促进肿瘤免疫逃逸
丁香学术
1924 年,德国生物化学学家 Otto Warburg 发现肿瘤细胞即使是在氧气充足情况下,优先选择通过糖酵解而不是三羧酸循环获取能量,即 Warburg 效应。Warburg 效应满足了肿瘤细胞为了适应其快速生长对能量和代谢物质的需求,并有助于维持细胞内部氧化还原稳态。Warburg 效应与肿瘤发生发展的相互调控关系及其在临床中的应用已成为近年来肿瘤研究领域的热点之一。
肿瘤细胞的免疫逃逸是肿瘤得以发生发展乃至转移的重要条件。肿瘤细胞常会表达 PD-L1 蛋白来抑制 T 细胞等免疫细胞的活性,这是肿瘤免疫逃逸的一个重要机制。目前,针对 PD-L1 或 PD-1 的单克隆抗体已被应用到多种肿瘤的治疗上,并显现出了良好的治疗效果。但是,肿瘤细胞 PD-L1 表达是否受肿瘤微环境的营养物质、以及细胞内代谢酶和代谢物质的调控等尚不清楚。
2022 年 8 月 24 日,浙江大学转化医学研究院/附属第一医院吕志民教授团队在 Cell Metabolism 杂志在线发表了题为 Aerobic glycolysis promotes tumor immune evasion by hexokinase 2-mediated phosphorylation of IκBα 的文章,报道了肿瘤细胞 Warburg 效应促进肿瘤免疫逃逸的重要发现。
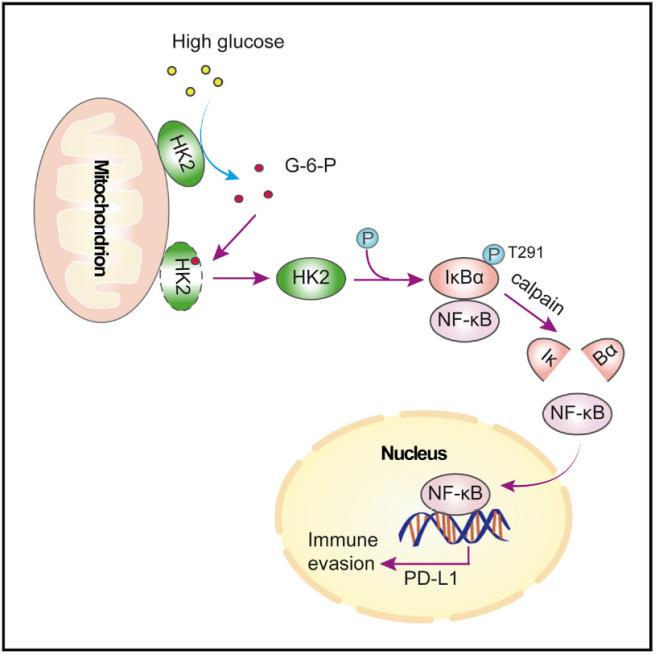
己糖激酶 2(Hexokinase 2, HK2)是催化糖酵解途径中的第一步反应的关键代谢酶,将葡萄糖磷酸化为 6-磷酸葡萄糖,主要定位在线粒体外膜上。HK2 在许多肿瘤中都呈现出高表达,在促进 Warburg 效应产生上起到重要作用。该项研究发现了 HK2 的全新功能,即在高水平糖酵解情况下,HK2 催化产生的过量的 6-磷酸葡萄糖促进 HK2 从线粒体外膜脱落,进入细胞浆中。在细胞浆中,HK2 结合 NF-κB 的抑制因子 IκBα。
重要的是,HK2 发挥了不依赖于其经典代谢功能的新功能,即作为一个蛋白激酶磷酸化 IκBα 的 Thr 291 位点。该磷酸化促进了蛋白酶 μ-calpain 与 IκBα 的结合并进一步降解 IκBα,进而使转录因子 NF-κB 入核,最终促进了 PD-L1 的表达并导致了肿瘤的免疫逃逸。作者还发现,使用己糖激酶的抑制剂与 PD-1 抗体联用治疗小鼠胶质瘤,可以显著提升 PD-1 抗体的治疗效果。
本研究阐明了 HK2 作为一个葡萄糖感受器,感应细胞内葡萄糖水平,通过经典与非经典的功能的转换以连接能量代谢与肿瘤免疫,揭示了 Warburg 效应促进肿瘤免疫逃逸的机制。该研究不仅为癌症的个体化治疗揭示了新的代谢标记物和分子靶点,而且对靶向肿瘤代谢和肿瘤免疫的药物研发具有重要的指导意义。
肿瘤的大量基因突变及特有的微环境,往往导致代谢酶原有的功能改变并赋予其新的非代谢酶功能。该研究是吕志民团队继发现糖代谢酶 PKM2 (Nature, 2011, PMID: 22056988; Cell,2012, PMID: 22901803; Molecular Cell, 2014, PMID: 24316223)、PGK1(Molecular Cell,2016, 2017, 2019, PMID: 26942675 , 28238651, 31492635)、KHK-A(Nature Cell Biology, 2016, PMID:2708854; Science Advances, 2019, PMID: 31032410)、PCK1(Nature, 2020, PMID: 32322062)和 CHKα(Molecular Cell,2021,PMID: 34077757)的蛋白激酶活性在肿瘤发生发展中发挥重要作用之后,发现的第六个具有蛋白激酶活性的代谢酶。这些研究改变了业界对肿瘤代谢的传统认知,为肿瘤代谢领域的研究做出了突出贡献。