肠道干细胞命运决定的全新机制!Nature 首次揭示小肠干细胞会发生「逆向」迁移
丁香学术
肠道是一个奇妙的地方,一层特殊的细胞覆盖在小肠和大肠的内部,从你所吃的食物中吸收营养和水分,同时防止有害物质进入你的身体系统。
这一层细胞被称为肠上皮,它遍布绒毛,看起来像覆盖小肠和大肠内部的小触手。在绒毛之间,组织中有微小的口袋,称为肠隐窝。在隐窝的底部,干细胞不断分裂,一些产生的细胞保留在隐窝中作为干细胞,而其他细胞则向外推向周围绒毛的尖端,最终分化成具有肠道功能的细胞类型,并在几天后被推出隐窝。
然而,不同部位的肠道干细胞数量和命运决定是如何调控的,至今仍是科学家们探索的话题。

图源:参考资料 [1],Credit: SHUTTERSTOCK
2022 年 7 月 13 日,由荷兰癌症研究所和奥地利科学技术研究所的等多个单位组成的国际科研团队在 Nature 上发表了题为 Retrograde movements determine effective stem cell numbers in the intestine 的研究性论文。
他们基于活体显微技术等研究方法,首次揭示了一种独特的干细胞调控模式——小肠干细胞利用从隐窝边缘向隐窝基部的逆向迁移,以维持大量的具有功能性的干细胞。这种细胞运动模式是由潘氏细胞分泌的 Wnt 蛋白所驱动的,在大肠隐窝中并不存在。
这些发现揭示了肠道干细胞的一种全新的细胞行为,为理解干细胞调控以及小肠和大肠之间在生理和疾病方面的差异(如为何癌症常见于大肠而非小肠),提供了新视角。
图源:Nature
研究内容
小肠干细胞存在「逆行」迁移运动
首先,研究者设计了一种策略,可以在数周内对活体小鼠体内的同一个隐窝进行重复成像。结合数学建模,成像数据表明,隐窝中表达 Lgr5(干细胞标志物)的细胞的干细胞「潜力」取决于两种行为。
首先是细胞分裂:分裂的细胞更容易丢失,因为被动的细胞重新定位将新生的子细胞推向远离隐窝的位置。第二个令人意想不到的行为是细胞的主动重新定位——隐窝中的干细胞经常向下迁移,朝向隐窝基部运动(图 1a)。这种「逆行」迁移增加了干细胞保留在生态位中的几率。
这一现象与研究团队最初的预测相反,他们原本认为大多数干细胞再生(而不是导致分化的细胞类型)是由位于隐窝底部的细胞驱动,但这一结果表明小肠中干细胞的长期存活与它们在隐窝中的初始位置无关。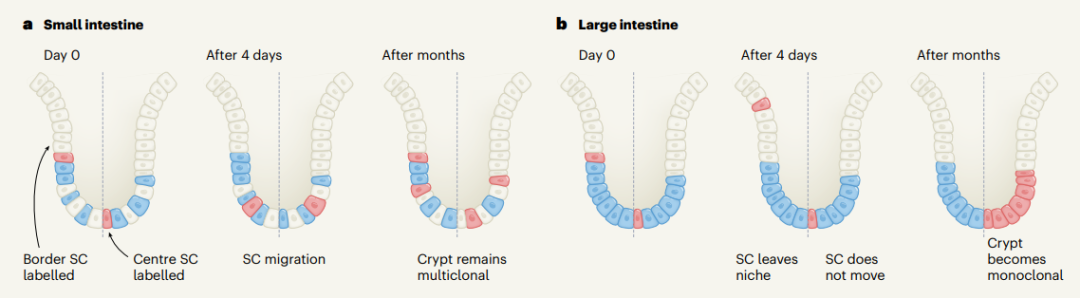
图 1 肠道中的干细胞迁移(图片来源:参考资料 [3])
小肠和大肠中功能性干细胞的数量并不相同
大肠结构与小肠非常相似,干细胞也存在于隐窝中,并由表面标记 Lgr5 识别,以及 Lgr5 阳性细胞的整体数量大致相同。因此,研究者随后探索了在大肠中是否存在类似的逆行迁移机制。然而,在大肠隐窝中几乎没有观察到干细胞的逆行迁移和重排(图 1b)。
这一发现表明,在大肠中,离隐窝基部最远的表达干细胞标志物 Lgr5 的细胞并不能有效地充当干细胞发挥作用,它们不能重新定位到隐窝基部,会相对迅速地被推出隐窝,对肠道的长期更新没有任何贡献。因此,虽然经典标记物 Lgr5 预测小肠和大肠中干细胞的数量大致相同,但实际上小肠中真正具有功能性的干细胞数量是大肠中的两倍。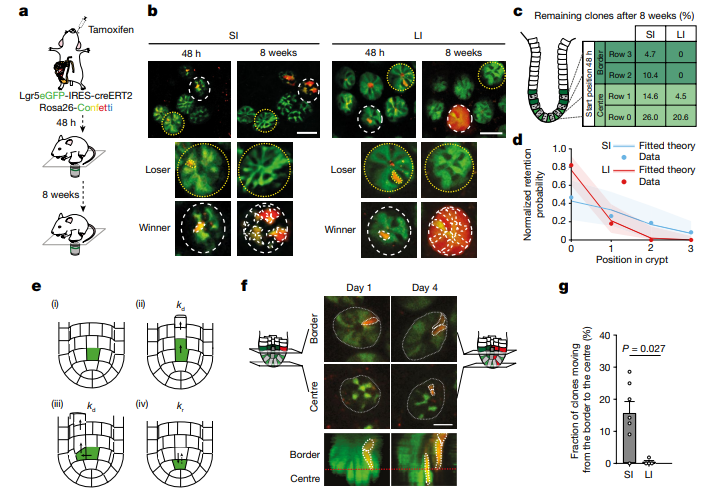
图 2(来源:参考资料 [2])
Wnt 蛋白促进 LGR5+细胞迁移
接下来,研究人员试图确定驱动小肠干细胞「逆行」迁移的因素。
Wnt 被认为是诱导干细胞潜能的主要生态位因子之一,由小肠隐窝中的潘氏细胞(Paneth cells)产生,而大肠隐窝中不含有潘氏细胞。为了测试潘氏细胞产生的 Wnt 是否具有诱导 LGR5+ 细胞迁移的潜力,研究人员分离了 LGR5+ 细胞,并接种到低吸附的圆底板上,使用共聚焦显微镜对它们的迁移进行成像。有趣的是,当细胞暴露于潘氏细胞时,迁移细胞的位移增强,当 Wnt 的分泌被抑制时,这种迁移增强效果被消除;当直接用外源性 Wnt 刺激 LGR5+ 细胞时,迁移甚至进一步增强。
以上结果表明,潘氏细胞分泌的 Wnt 蛋白可以促进 LGR5+ 细胞的迁移。这可以解释为何小肠隐窝比大肠隐窝有更多的有效干细胞和更快的 LGR5+ 细胞再生速度。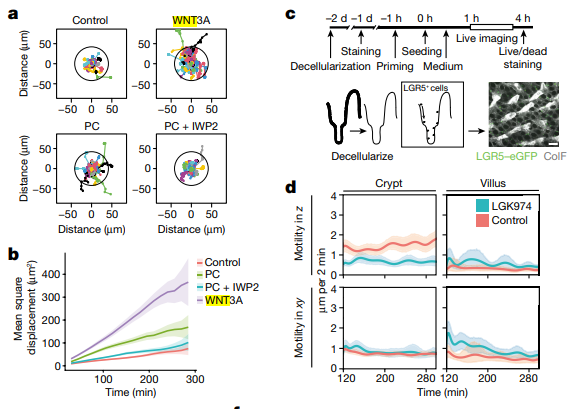
图 3(来源:参考资料 [2])
总结
小肠细胞会被细胞分裂从隐窝中向外推,发生像传送带一样的向上运动,该研究首次发现,这一过程中还会发生 Wnt 依赖的细胞「逆行」迁移,通过这种方式,已经沿着「传送带」向外移动的细胞最终可以回到隐窝基部,并再次作为干细胞分裂。因此,远离隐窝基底的小肠细胞可以作为长期有效的干细胞。
然而,大肠中的干细胞几乎没有逆行运动,限制了细胞的重新定位,导致大肠中有效干细胞数量的减少。而且,抑制小肠逆行运动后,有效干细胞数量减少,隐窝单克隆转化速度加快。这些结果表明,有效干细胞的数量是由积极的逆行运动决定的,揭示了一个新的干细胞调控通道。
本研究的共同通讯作者 Edouard Hannezo 解释了这些发现的可能含义,「这些运动构成了一种新的环境机制,决定了哪些细胞在功能上可以充当干细胞。在小肠中,调节运动的分子信号比在大肠中更强,因此细胞可以更频繁地移回隐窝。这就解释了为什么小肠中实际起作用的干细胞比大肠中的干细胞更多。这可能对我们理解干细胞到底是什么,以及如何在医疗应用中调控干细胞产生重大影响」。