小鼠脾脏单细胞悬液制备流程及注意事项
Elabscience
10291
小鼠脾脏单细胞悬液制备流程
- a)研磨法
- 小鼠颈椎脱臼处死,置于75%酒精浸泡5 min后,取出小鼠,置于无菌操作台上,左腹侧朝上。
- 小鼠左腹侧中部剪开小口,撕开皮肤,暴露腹壁,可见红色长条状脾脏。
- 脾脏下侧提起腹膜,剪开后上翻,暴露出脾脏。用镊子提起脾脏,眼科剪分离脾脏下面的结缔组织,取出脾脏,并浸泡于干净的PBS溶液中。
- 将脾脏置于200目筛网中,用组织研磨棒轻轻研磨至没有明显红色块状物。
- 用15 mL PBS冲洗筛网,并将冲洗液收集于15 mL离心管,300 g离心5 min,弃上清。
- 加入2 mL 1×红细胞裂解液重悬细胞,室温裂解2~3 min后,立马加入10 mL PBS,300 g离心5 min,弃上清。
- 用细胞染色缓冲液重悬脾脏细胞,将细胞悬液用200目筛网再次过滤后计数, 并调整细胞浓度至1×107/mL。
- b) 吹打法
- 小鼠颈椎脱臼处死,置于75%乙醇浸泡5 min后,取出小鼠,置于无菌操作台上,左腹侧朝上。
- 小鼠左腹侧中部剪开小口,撕开皮肤,暴露腹壁,可见红色长条状脾脏。
- 脾脏下侧提起腹膜,剪开后上翻,暴露出脾脏,用镊子提起脾脏,眼科剪分离脾脏下面的结缔组织,取出脾脏并浸泡于干净的PBS溶液中。
- 取无菌的2.5 mL的注射器吸取PBS,左手用镊子夹持脾脏,右手持注射器,小心插入脾脏中吹打,至脾脏细胞完全被吹打干净,观察只剩余白色的结缔组织和脂肪组织为止,镊子夹取剩余的白色组织在PBS中轻轻润洗。
- 将吹打出的细胞用200目筛网过滤,收集于15 mL离心管,300 g离心5 min,弃上清。
- 加2 mL 1×红细胞裂解液重悬细胞,室温裂解2~3 min,立马加入10 mL PBS,300 g离心5 min,弃上清。
- 用细胞染色缓冲液重悬脾脏细胞,计数,并调整细胞浓度至1×107/mL。
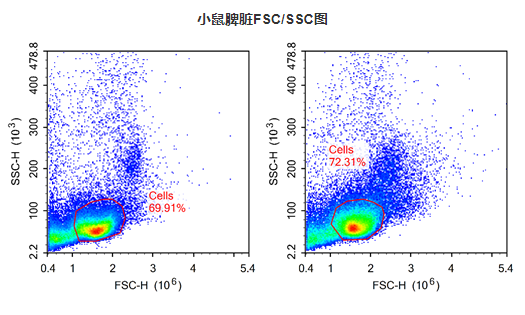
注意事项:
- 一个正常大小的脾脏,根据经验大约可以得到4×107个细胞,实际细胞数以计数结果为准。
- 淋巴细胞约占小鼠脾脏裂解红细胞后总细胞量的60%~70%。
- 未染色的脾脏细胞样本,可以在荧光通道中看到少量(大约百分之零点几)非特异性信号。
- 若没有组织研磨棒,也可以用注射器里面的推杆替代。用推杆前端的橡皮垫研磨脾脏。
- 收集的脾脏细胞如需进一步培养,取小鼠脾脏时需置于无菌操作台上。如果只是做普通的流式实验,则可以不考虑无菌环境。
- PBS可以用细胞染色染冲液替代。
- 裂解红细胞这一步,裂解时间具体以实验过程中裂红的效果来判断。











