简介
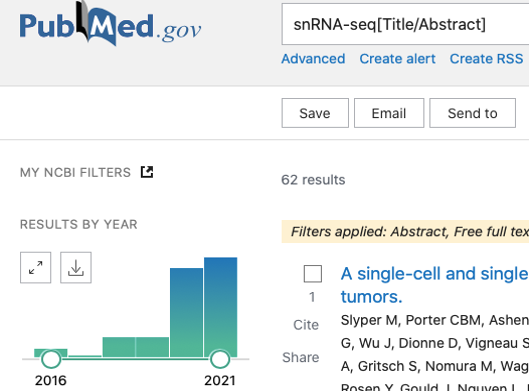
说到单细胞测序,大家都比较关心样本送到实验室后需要经过怎样的处理才能正式上机测序,今天就带大家了解下测序最关键的第一步——单细胞悬液制备。
一般肿瘤组织比较容易解离并获得高质量的单细胞悬液。组织解离后的死细胞及碎片等虽然可通过后期的清洗、死细胞去除、密度梯度离心等手段去除。但相应也会增加样本处理的时间,影响细胞活性。因此肿瘤组织取材的前处理就非常重要。
原理
1.取材注意事项:
检查组织是否被冲洗干净。若在取材后不及时冲洗,极易引起红细胞含量增多,造成后续实验污染。
所取样本组织需挑除部分因供血不足或由于机体的免疫反应形成的坏死区域,这些区域在消化后会产生大量的死细胞,影响最终活率。
检查组织运输回来后,冰袋及组织冻存液的剩余含量。组织在离体后数个小时,依旧还是新鲜状态,还在消耗着养分,因此组织冻存液中的营养要供应充足,同时温度也要尽量维持在 4 ℃,使得细胞处在最低耗能的条件下依然存活。
2.细胞悬液制备步骤:

组织剪碎→解离液水浴消化→过 70μm 筛→离心→裂红(细胞)→再次离心→过 35μm 筛
3.具体实例:
解剖小鼠,取其具体靶器官时,一般采取断颈的方式,优势是处理快速、方法通用,但会引起体内局部(尤其是胸腔)内凝血,对心脏、主动脉和肺等组织有一定影响;解剖过程,务必快速准确,尽量减少细胞活性的损失;
冲洗过程,一般采用预冷的生理盐水/ PBS /D-Hanks`液/ RPMI-1640 等液体。此步骤注意两点:预冷+维持细胞活性的「液体」。一般情况下,建议 RPMI-1640 添加 FBS 至 10% 终体积(其实就是完全培养液)。也有老师用终浓度 1-5% 的 BSA,其实作用都是为了提高细胞悬液制备过程中的细胞活性。
剪碎过程,注意两点:快速 + 1mm3 最好。可以准备一次性的平皿,提前注入 1-3 ml 预冷的完全培养液,在预冷环境中剪碎组织。
胶原酶消化,这一步注意事项较多。

首先,明确适用于该组织的胶原酶,详细情况见上面表格
其次,使用终浓度,以活性单位浓度 UI/ml 为基准。大多数的 II 或 IV 型胶原酶的使用浓度为 100-200 UI/ml。
最后,注意消化时间。一般情况下,胶原酶在 37℃ 条件下活性最强,消化时间为 20-30 min
终止酶的消化,采用离心—弃上清—加培养液重悬方式洗去残留的胶原酶。至于细胞碎片,这一步基本上都是通过低转速短时间离心的方式进行的,基本上 300g-500g,5 min-8 min 即可。既保证活细胞离心收集,又保证细胞碎片悬浮在上清中被弃掉。
红细胞裂解,尽量在初步分离细胞的时候把红细胞去除干净。不过,像心脏和肝脏这样的组织,本身红细胞含量就超级高,裂红在所难免。如果除不太干净,可重复裂红一次,但总次数尽量不要超过两次。
材料与仪器
步骤
1.取材注意事项:
检查组织是否被冲洗干净。若在取材后不及时冲洗,极易引起红细胞含量增多,造成后续实验污染。所取样本组织需挑除部分因供血不足或由于机体的免疫反应形成的坏死区域,这些区域在消化后会产生大量的死细胞,影响最终活率。检查组织运输回来后,冰袋及组织冻存液的剩余含量。组织在离体后数个小时,依旧还是新鲜状态,还在消耗着养分,因此组织冻存液中的营养要供应充足,同时温度也要尽量维持在 4 ℃,使得细胞处在最低耗能的条件下依然存活。
2. 细胞悬液制备步骤:
组织剪碎→解离液水浴消化→过 70 μm 筛→离心→裂红(细胞)→再次离心→过 35 μm 筛
3. 具体实例:
解剖小鼠,取其具体靶器官时,一般采取断颈的方式,优势是处理快速、方法通用,但会引起体内局部(尤其是胸腔)内凝血,对心脏、主动脉和肺等组织有一定影响。
(1) 解剖过程:务必快速准确,尽量减少细胞活性的损失;
(2) 冲洗过程:一般采用预冷的生理盐水、PBS、D-Hanks——液、RPMI-1640 等液体。此步骤注意预冷并维持细胞活性的「液体」。一般情况下,建议 RPMI-1640 添加 FBS 至 10% 终体积(其实就是完全培养液)或者用终浓度 1~5% 的 BSA,都是为了提高细胞悬液制备过程中的细胞活性。
(3) 剪碎过程:注意快速,大小为 1 mm3 最好。可以准备一次性的平皿,提前注入 1~3 mL 预冷的完全培养液,在预冷环境中剪碎组织。
(4) 胶原酶消化:这一步注意事项较多。首先,明确适用于该组织的胶原酶;其次,使用终浓度以活性单位浓度 UI/mL 为基准,大多数的 II 或 IV 型胶原酶的使用浓度为 100~200 UI/mL;最后,注意消化时间,一般情况下,胶原酶在 37 ℃ 条件下活性最强,消化时间为 20~30 min,采用离心→弃上清→加培养液重悬方式洗去残留的胶原酶。至于细胞碎片,这一步基本上都是通过低转速短时间离心的方式去除,300 g~500 g,5 min~8 min 既保证活细胞离心收集,又保证细胞碎片悬浮在上清中被弃掉。
(5) 红细胞裂解:尽量在初步分离细胞的时候把红细胞去除干净。不过,像心脏和肝脏这样的组织,本身红细胞含量就超级高,裂红在所难免。如果除不太干净,可重复裂红一次,但总次数尽量不要超过两次。
文章来源:烈冰生物
来源:丁香实验