简介

材料与仪器
步骤
3.详细实验步骤解析
实验前准备:
酶解液的预处理:将现配的 Enzyme solution 55℃ 水浴 10 min 后,冷却至室温,加入 10mM CaCl2 和 0.1% BSA (Sigma-Aldrich)
具体实验步骤
按照花序样品的长度分期,取不同生长阶段的水稻花序,阶段 1 (S1), < 2 mm;阶段 2 (S2), 2-3 mm。
(1)组织剪碎:取生长状况良好的花序组织,用干净的手术刀片快速且轻柔地将每颗花序切割成小颗粒;
(2)孵育:20% D-甘露醇高渗溶液,室温暗孵育 5-10min,促使细胞质壁分离,利于后续细胞壁的降解;
(3)将孵育后组织转移至干净滤纸上,轻柔且快速的吸干组织外表皮溶液;
(4)组织消化:室温下去除细胞壁,利用不含 RNase 的酶溶液消化体系制备原生质体,试剂配比如下:
Cellulose R-10;
Macerozyme R-10(Yakult, Japan);
0.4 M mannitol;
20 mM MES(pH 5.7);
20 mM KCl;
10 mM CaCl2;
0.1% BSA (Sigma-Aldrich)
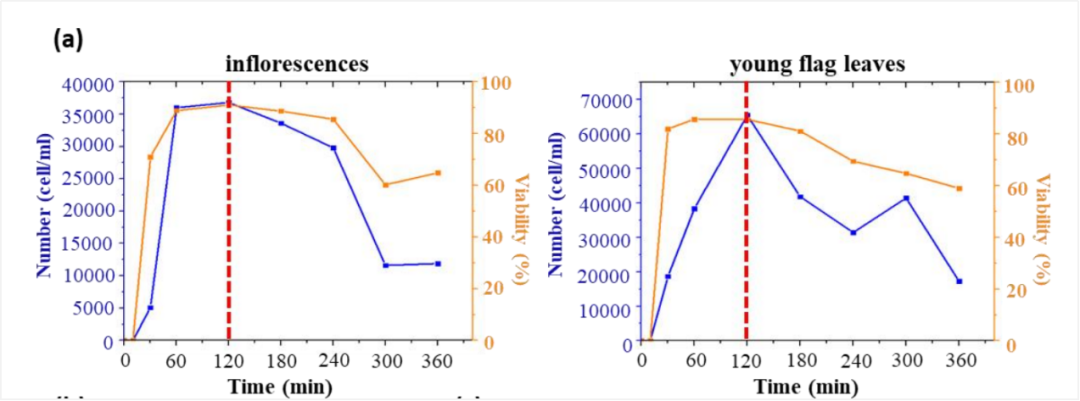
每间隔 1h 取 5μL 镜检,掌握原生质体酶解情况;
(5)过筛:45μm 细胞过滤器(Biologix,Biologix Group Ltd)过滤原生质体,取过滤后悬液到 10ml 圆底离心管中;
(6)低温离心:200g 离心 3 分钟去除上清;
(7)去除残留酶液:用 8% (w/v) 甘露醇洗涤沉淀原生质体 3 次,加入甘露醇的量视原生质体而定;
(8)细胞悬液质控:8%(w/v) 甘露醇使原生质体重悬,通过吖啶橙-碘化丙啶(AO/PI)染色并用 Countstar 全自动荧光细胞分析仪测定细胞消化后获得原生质体的数量和细胞活力;
(9)单细胞捕获:质控合格的原生质体样本重悬至 800~1000 cells/μL,后续利用单细胞捕获平台或烈冰 PanoCell 双通道微孔芯片捕获原生质体。
4. 注意事项
(1)手术刀切碎过程避免拖拽,以防破坏原生质体;
(2)酶溶液消化后的实验步骤均在冰上进行操作;
(3)过筛时离心管保持一定的倾斜角度,使液体沿管壁下流,减少液体冲击造成的细胞损失;
(4)去除上清的枪头使用宽口枪头,操作轻柔,以防破坏原生质体;
(5)镜检和质控过程,每间隔 1h 取 5μL 镜检,掌握原生质体酶解情况,本实验持续测定 6h,发现水稻花序原生质体制备的细胞活力的最佳时间为 2 小时。
参考文献:
Zong J, Wang L, Zhu L, et al. A rice single cell transcriptomic atlas defines the developmental trajectories of rice floret and inflorescence meristems. New Phytol. 2022;234(2):494-512.
doi:10.1111/nph.18008
文章来源:烈冰生物
来源:丁香实验