简介
通常,单细胞测序选择的样本组织是新鲜的组织、血液、培养的细胞系或制备好的单细胞悬液。因此如何将样本快速安全的转运到实验室中处理?这是决定单细胞测序质量好坏的一个重要因素,下面我们将给大家介绍几种不同的样本及样本转运前处理:
材料与仪器
步骤
1、新鲜组织样本
新鲜组织样本包括实体瘤组织样本和临床穿刺样本,实体瘤组织样本常见于患者切除的组织、实验模型动物的脏器组织等,而穿刺样本是指在采集样本过程中使用粗针(穿刺针针管外径≥1.2 mm)穿刺采集 3-5 条样本。
(1)针对于实体瘤组织样本,在取样过程中应注意:
① 实体瘤组织需新鲜的样本,且没有经过冷冻、固定等处理。
② 取样后的组织上不能有血凝块,可以在取样后使用 PBS 清洗粘在组织块上的血液。
③ 运输前,要将组织放置在组织冻存液或缓冲液(注意应无钙、镁、EDTA 等影响酶活性物质,可使用 0.04% BSA 的 PBS)。
④ 4℃ 条件下暂存及运输,通常将组织放置在冰盒中运输。
(2)实际操作步骤:
① 取好所需组织块后,将组织块切成黄豆粒大小(100mg 左右)小块,如组织内细胞含量十分多,可以切成绿豆粒大小,方便细胞分选。细胞量要尽量保证在 1×106 cells 以上;
② 用无菌 PBS (或无菌生理盐水)清洗 2 遍,立即放入预冷的组织保存液中,用塑料泡沫包裹置于 4℃ 冰盒中暂存。
③ 样本收集完毕后,需在 24 小时内送到实验室内制备成细胞悬液。

(实体瘤组织样本,图片来源:烈冰助力单细胞文章https://doi.org/10.1016/j.immuni.2021.04.027)
(3)针对于穿刺组织样本,在取样过程中应注意:
穿刺组织样本中包含的细胞数量至少应达到 1×105 cells 以上,细胞活性大于 70%。
穿刺样本在采集过程中可以使用粗针(穿刺针针管外径≥1.2mm )穿刺采集 3-5 条样本,但不能用真空针采样。

(穿刺组织样本,图片来源:网络)
2、外周血样本及 PBMC 样本
外周血(全血)做单细胞测序通常是分析粒细胞,而外周血单个核细胞(Peripheral blood mononuclear cell,PBMC)是外周血中具有单个核的细胞,包括淋巴细胞和单核细胞,通常分析药代动力学相关的内容时,二者都是研究人体细胞异质性的重要样本。
(1)针对于外周血样本,在取样过程中应注意:
① 外周血(全血)样本取样时需置于 EDTA 抗凝管中;
② 采血管无破损,血液离体后不超过 48h,EDTA 抗凝管没有过期,全血体积≥5mL,样本无严重溶血、无血凝块;
③ 在样本量充足的情况下,可以多设置 1-2 组重复;
④ 在寄送装有血液的抗凝管时,需用泡沫包裹,保证 4℃ 左右的低温环境;
⑤ 2-8℃ 条件下暂存及运输。
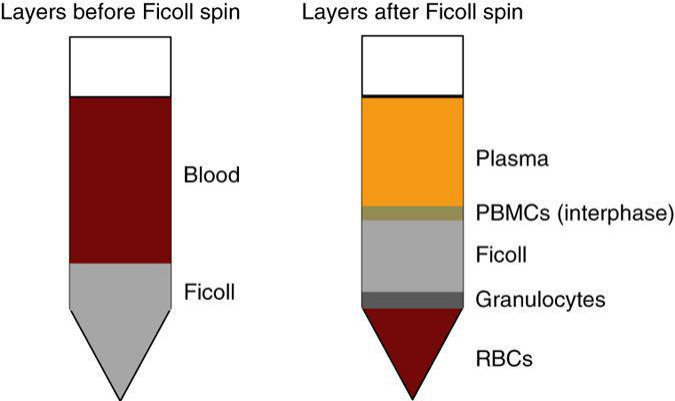
(2)针对于 PBMC 样本,一般 PBMC 分离方法如下:
实验流程:
① 抗凝血使用前需颠倒混匀;
② 准确量取抗凝血体积并加入等体积的 PBS,平放离心管,缓慢旋转管壁数次,以使 PBS 和血液混匀;
③ 在另一离心管中加入与混合液等体积的淋巴细胞分离液,将淋巴细胞分离液的离心管倾斜成和水平面 30-45 度角,然后另一手拿混合管沿着淋巴细胞分离管管壁,慢慢倒入淋巴细胞分离管中,(注意:最开始倾倒时,需缓缓倒入,而且倒入后需等待数秒,再继续倾倒)。待抗凝血铺满分离液液面时,可稍加速倾倒,随着分离液管中血液的增多,需将分离管缓慢竖直。
④ 待血液完全倒入分离管后,可以看到分离液和血液有明显分层。离心管尽量减少震动,对称放入离心机中。800g 离心 20min。如果取样时间较长(2h 以上),可延长离心时间至 30min。离心结束后,将离心管从适配器中旋转取出。此过程应缓慢,尽量避免震荡。
⑤ 直接将吸管深入中间层,沿着管壁缓慢吸入,并不时移动吸管,将淋巴细胞转入一个新的 1.5ml 离心管中。
⑥ 将离心管放入离心机中,400g 离心 10min。用 200ul 枪头缓慢吸取离心管中液体,吸取过程中避免吸到细胞沉淀,完全吸干净液体。
获得 PBMC 后,向离心管中加入相应试剂,进行后续实验。
(3)样本质控标准
对于所有制备成细胞悬液的样本,均需要关注采集后样本质量:
① 细胞活性大于 70%
② 浓度为 700-1200 细胞/μL
③ 体积不小于 100 μL
④ 细胞培养基及缓冲液不能含 Ca2+ 和 Mg2+
⑤ 细胞体积小于 40 μm
⑥ 细胞结团率低于 20%
文章来源:烈冰生物
来源:丁香实验


![VX2[暂不提供]兔实体瘤细胞](https://img1.dxycdn.com/p/s14/2025/0515/972/2179102338410582291.jpg!wh200)