小鼠肿瘤样本单细胞悬液的制备及注意事项
Elabscience
3194
小鼠肿瘤样本制备
- 颈椎脱臼法将荷瘤小鼠处死,75% 酒精浸泡 5 min,取出小鼠置于无菌操作台上。
- 左手持镊子,右手持弯剪,沿肿瘤边缘剪下长约 1cm 的口子,可清晰看见肿瘤附着于皮下,沿肿瘤边缘轻轻剪开连接处,剥离肿瘤。
- 将剥离的肿瘤放入100 mm 的培养皿中,并在室温下加入 5~10 mL 的 1640 基础培养基。
单细胞悬液的制备
A.混合酶消化法
- 待所有肿瘤剥离完毕后,将肿瘤转移至 1.5 mL EP 管中,手持弯剪将肿瘤充分剪碎,边剪边加入1640基础培养基,静置数秒,使用 1 mL 移液器吸出上层较小颗粒,继续剪碎组织,重复加入1640基础培养基,直至所有的组织大小均符合要求。
- 将肿瘤组织悬液转移至 50 mL 离心管中,加入 1640 基础培养基,250 g离心5 min,弃上清,加入4.5 mL 的 1640 基础培养基,重悬细胞沉淀并转移至培养皿中。
- 加入 500 μL 的 10×Triple Enzyme stock solution 混合酶溶液,轻轻吹打至充分混匀,转移至37℃水浴摇床消化孵育 1~2 h。
- 消化结束后用 1640 基础培养基或者 PBS 稀释,再用 200 目筛网,除去残留的组织块,并使用5~10倍体积的 1640 基础培养基或者 PBS 缓冲液洗涤一次,过滤至无组织块为止,获得单细胞悬液。
- 收集细胞悬液,300 g离心5 min,弃上清。
- 用细胞染色缓冲液重悬细胞,并调整细胞浓度至 1×107/mL。
- 研磨法
- 提前准备好 200 目的一次性细胞筛网,用 1640 基础培养基或者 PBS 润湿并浸泡备用(浸泡放置于 6 cm 细胞培养皿或者 6 孔板)。
- 将剥离的肿瘤组织转移到 200 目的细胞筛网,用无菌眼科剪剪成小颗粒。
- 取 2.5 mL注射器活塞,用软头打圈方式研磨组织,研磨至筛网上无明显的组织块为止,取新鲜的 1640培养基或者 PBS 冲洗筛网 2~3 次。
- 将获得的细胞悬液用 200 目细胞筛网过滤。
- 收集细胞悬液,300 g离心5 min,弃上清。
- 用细胞染色缓冲液重悬细胞,并调整细胞浓度至 1×107/mL。
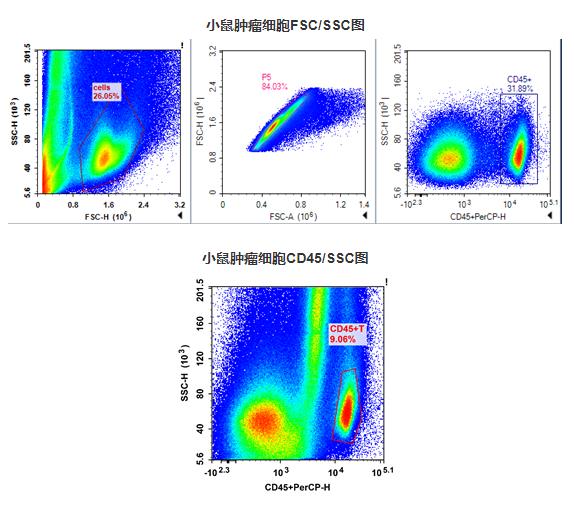
-
注意事项:
- 肿瘤体积一般不超过 1000 mm3,肿瘤质量在 0.6~0.8 g 之间。(若肿瘤较大下述各反应体系加倍)。
- 酶消化法剪刀剪碎肿瘤的标准为,其可被1 mL 的枪头自由吸取,无阻碍。
- 酶消化法时要避免组织消化过度,需要每隔 20 min取出观察,无明显组织块后即结束消化;细胞团块越小,消化越快,1 mL 移液器可以吹打的组织块,约消化 30~60 min 即可完成;若组织难以剪切,也可以切成大小 1~2 mm3 左右大小,每 30 min 用 1 mL 的移液器吹打混匀一次,直至可以顺畅通过,约 1~2 小时可以充分消化。
- 研磨时为尽量减少细胞损伤,需要浸泡于培养基中研磨,避免干磨。