一文搞定纯化实验 7 大常见问题!
丁香实验
你是不是每次做纯化实验心里都会默念:退!退!退!
有关纯化实验的所有问题都退!感觉像是在作法而不像是在做实验。
虽然蛋白纯化被认为是考验基本功的实验,但接踵而至的考验只会让原本不熟练的实验雪上加霜,导致纯化实验失败了一次又一次……
失败原因五花八门,比如:标签蛋白纯不出来,过了分子筛跑 SDS 胶还一堆杂带?面对着样品的精细分离,却不会选层析柱?纯化得到的组分中没有或只有少量目的 His 标签蛋白,知道了蛋白等电点却不知如何选择离子交换层析......
遇到这些问题别担心,「纯化密卷」来帮忙!!
在这份 CIPP(Capture, Intermediate purification,Polishing,层析策略)纯化密卷中,我们对大家纯化过程中遇到的常见问题,一一做出了解答,更有九大层析策略,让专业的人帮你搞定一切困难~
生物分子间的分离纯化主要依据分子间在物理和化学性质上的差异来实现的,包括大小、电荷、疏水和极性等,部分蛋白还具有特殊的亲和特性。另外,可以综合利用多种不同的性质差异,采用特殊的「多模式填料」进行分离。
每种层析技术各有优势和特点,「组团出道」才能到达最佳的纯化效果。希望通过这份密卷,能够加速大家的纯化之路,由凝胶过滤、标签蛋白纯化、抗体纯化、离子交换、层析空柱等内容构成。
绝招一:凝胶过滤预装柱堵了、超压的处理方式
可能原因:缓冲液或样品未进行过滤、蛋白沉淀或杂质残留、清洗不及时等引起层析柱滤膜堵塞;流速过快、流动相粘度(如乙醇等)过高、温度过低。
建议处理方法:首先卸柱子,确定是系统还是柱子堵了。如果是柱子堵了:参考说明书 CIP 操作进行清洁;更换层析柱顶端滤膜或超声清洗(HiPrep 与 Precision Columns 3.2/300 柱型不能拆卸换膜);必要时移除层析柱顶端 2~3 mm 凝胶,调节 Adaptor 消除顶端死体积。部分预装柱,也可以将填料倒出,去除板结或碎填料后,重新装填。测定柱效或重复之前做过的样品。后续注意样品前处理(如核酸的去除、样品缓冲液条件)以及层析柱的日常维护。
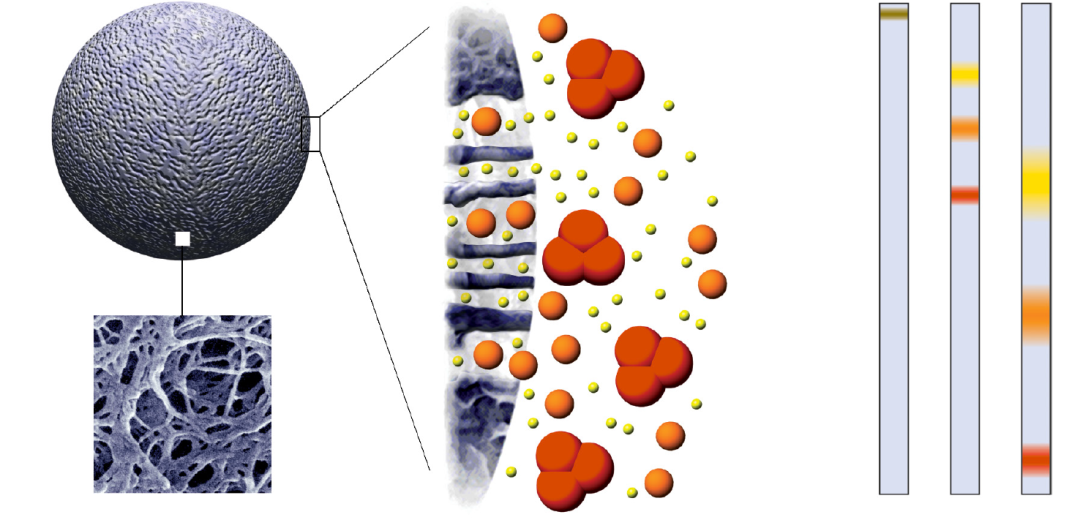
图 1:凝胶过滤分离原理
绝招二:凝胶过滤层析的三大应用种类
根据应用目的的不同,凝胶过滤层析主要可以分为以下三种方法 :
● 制备级凝胶过滤纯化:对于分辨率有较高的要求:
(1)上样体积一般在柱体积的 0.5%~4% ;
(2)运行较低的流速 ;
(3)使用较高的柱子(一般 ≥ 60 cm)。
经过纯化后的样品将被直接置换到合适的缓冲液条件中,用于后续的实验或储存。
● 分析型凝胶过滤层析:对于分辨率有很高的要求,上样体积一般在柱体积的 0.3%~0.5% ,使用柱子的高度一般为 30 cm。而在快速纯度检测和筛选实验中,常用的是 15 cm 柱高的柱子,可以在提供足够的分辨率的前提下,缩短运行时间,节省样品和缓冲液。
● 脱盐与缓冲液置换:与上述的精细分离不同,脱盐或缓冲液置换属于组分分离,即将大分子样品与小分子或离子进行分离的过程,因此对于分辨率的要求相对不高。上样体积可达柱体积的 30%。
绝招三:使用凝胶过滤进行样品的精细分离时,应该这样选择层析柱
(1)根据目标蛋白的大小选择适合的分离范围。
(2)根据上样量,选择合适的柱体积的柱子类型。上样体积一般在柱体积的 0.5%~4%。
(3)根据具体需求确认柱子具体型号,一般选择高分辨率的柱子。
绝招四:纯化实验中常用的亲和标签汇总
Cytiva 提供多种亲和标签纯化产品,可用于纯化 His、GST、Strep(II)/ Twin-Strep、MBP 这些标签融合的重组蛋白。不同的标签蛋白在分子量、促溶性、结合特异性等方面各有特点,个性鲜明。
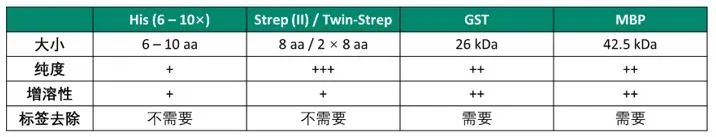
图 2:Cytiva 产品可用于纯化的主要亲和标签的性质对比
绝招五:纯化得到的组分中没有或很少目的 His 标签蛋白的主要原因分析
若目的 His 标签蛋白正常表达(使用抗 His 标签的抗体进行 WB 检测)且充分释放至上清中,确认蛋白是流穿还是未被洗脱 。
A:若目的 His 标签蛋白流穿
● 样品或结合缓冲液的条件不合适,注意螯合剂或强还原剂以及咪唑的浓度。
● His 标签蛋白与填料的结合较弱:降低上样流速或增加孵育时间;增加标签 His 的数量(常用 6~10 个)。
● His 标签未充分暴露:在变性条件(4~8 M 尿素或 4~6 M 盐酸胍)下进行纯化或测试;重新构建克隆,改变 His 标签的位置。
● 尝试其他的金属离子:如 Zn2+、Cu2+、Co2+ 等。
B:若目的 His 标签蛋白未洗脱
● 洗脱条件过于温和:增加咪唑浓度或降低洗脱 pH(注意:pH 降至 4.0 以下时 Ni2+ 会发生脱落)。
● 目的蛋白与填料发生非特异性疏水或其他相互作用:在洗脱缓冲液中加入非离子型去垢剂(如 2% Triton X-100)或提高 NaCl 浓度。
● 目的蛋白在填料中发生了沉淀:减少上样量;使用咪唑线性梯度而不是步级洗脱以降低洗脱得到的蛋白浓度;使用去垢剂或改变 NaCl 浓度;在变性条件(4~8 M 尿素或 4~6 M 盐酸胍)下洗脱。
绝招六:抗体的亲和纯化的常见方式
包括 Protein A、Protein G、Protein L 以及抗原特异性纯化。
抗体纯化策略:Cytiva 也提供了单克隆抗体多步纯化的成熟工艺平台。第一步采用 PrismA 等填料进行亲和捕获,第二步可以采用 adhere 多模式填料的抗体流穿模式去除宿主蛋白、内毒素、抗体聚集体、DNA、脱落的配基和病毒。也可以采用传统的三步法,在精纯步骤使用离子交换层析或针对复杂样品使用多模式层析达到更好的分离效果。
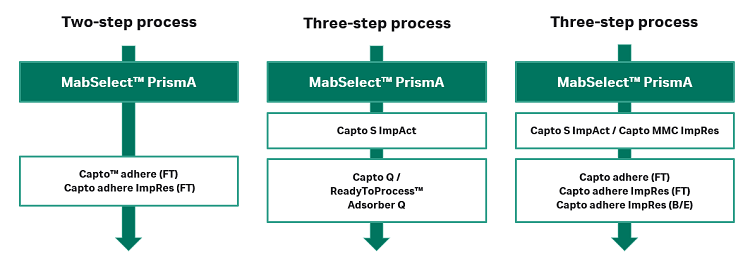
图 3:抗体的纯化路线
绝招七:已知蛋白等电点,离子交换层析的选择建议
离子交换层析(Ion exchange chromatography,IEX)是基于样品表面电荷的差异来进行样品分离的方法。不同的分子表面带电荷的性质不同,包括总带电荷量、电荷密度以及表面电荷分布,会和填料之间有不同程度的互作。样品分子在一定的离子强度和 pH 条件下结合到填料上,然后通过盐/pH 梯度进行洗脱。
自然界中绝大部分蛋白的 pH 在 5.8 或 9 附近,偏酸性更多。因此,针对未知样品,一般首先推荐强阴离子交换层析,如 Capto Q,使用中性缓冲液 pH 7~8。如果 Q 挂不上,可以再尝试强阳离子交换 Capto S 或 SP,选择 pH 5~6 范围。另外,可以选择样品流穿,杂质挂柱等方法。