外泌体分离:超速离心法 PK 试剂盒法,谁赢了?
和元生物
一、什么是外泌体?
外泌体(Exosomes)是大小为 30-150 nm、呈茶托状的细胞外囊泡(Extracellular vesicles, EVs),广泛存在于细胞培养上清及各种体液中,包括血液、淋巴液、唾液、尿液、精液、乳汁等。
几乎所有细胞都可以分泌外泌体,但是外泌体来源不同,其内部装载的 RNA、蛋白质、脂类等重要物质在数量和丰度上有很大差异。
二、外泌体的作用和功能
外泌体可通过传递信息影响目标细胞的功能,激活细胞信号通路,在免疫、凝血、肿瘤等生理病理过程中发挥作用。外泌体可以作为临床诊断中的生物标志物或疾病治疗的靶点,同时也可以作为药物载体,参与神经疾病和癌症等多种疾病的病理过程。
三、关键步骤 — 外泌体分离
外泌体的分离纯度对外泌体的功能研究非常重要,但是外泌体的分离一直是困扰外泌体研究人员的一个难题。虽然分离外泌体方法有很多种,包括差速超速离心法(超离法)、超滤法、密度梯度离心法、免疫磁珠法、试剂盒法等。
但目前文献中常用的分离外泌体的方法主要是超离法和试剂盒法,那这两种方法研究人员该如何选择呢?为了解决大家的疑惑,我们专门做了对比实验进行阐述。
四、超速离心法与试剂盒法比较
(一)实验分组和开展实验确定:
此实验共分为 3 组,每组设置 2 个重复,所选原始样本是 293T 细胞培养上清。
组1:超离法分离(UC-1,UC-2);
组2:使用某国外试剂盒 SXX(SXX-1,SXX-2);
组3:使用某国内试剂盒 UXX(UXX-1,UXX-2)。
开展的实验包括外泌体分离、透射电镜(TEM)、纳米颗粒检测(NTA)、BCA、WB。
(二)实验结果如下:
外泌体分离方法:此处步骤比较长,内容篇幅有限,暂且省略步骤,如有需要,可在微信公众号下面留言。
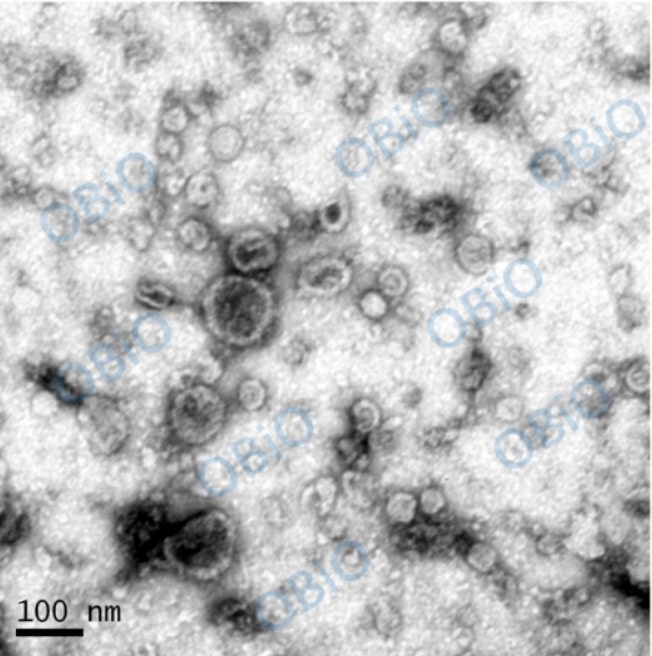
透射电镜拍摄:先制片,再拍摄。制片是先将外泌体固定在铜网上,再用 2% 醋酸双氧铀染色液染色,随后放于灯下烤 10 min,再拍照。
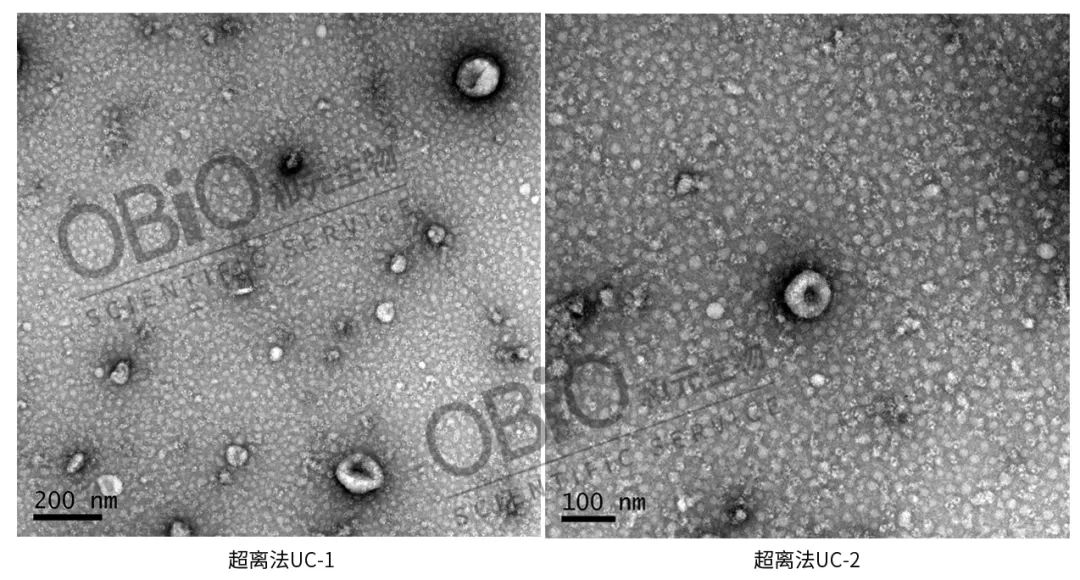
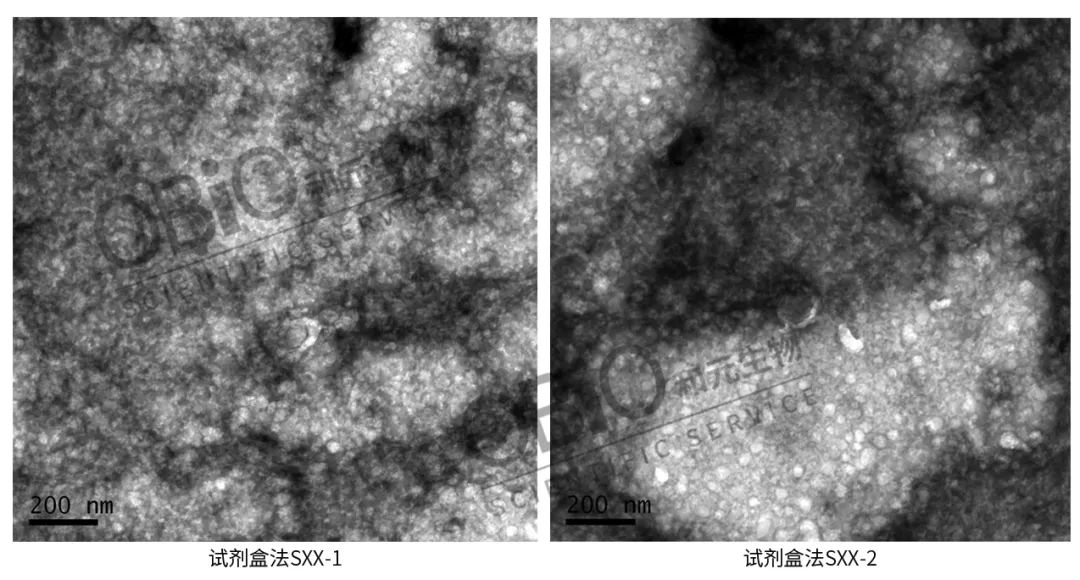
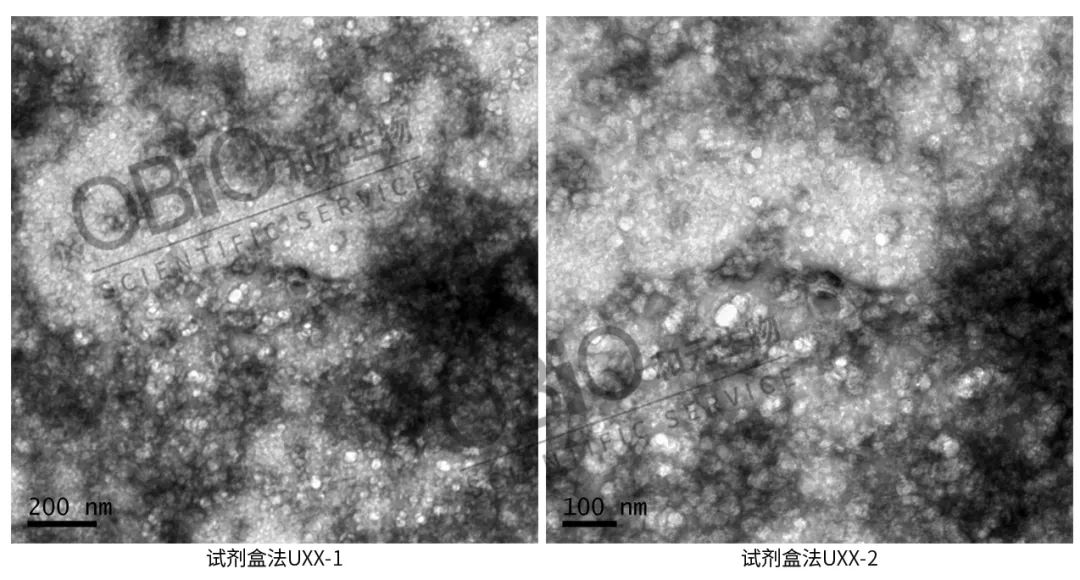
从上面的图片中可以看出,超离法相比较两种试剂盒的分离效果,纯度较高,电镜图片更清晰。
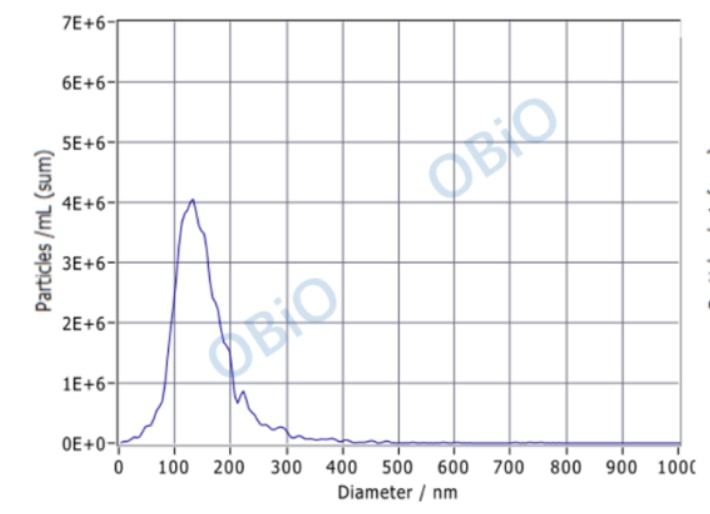
纳米颗粒大小检测:将外泌体样本进行稀释并检测,仪器自动出分析报告。
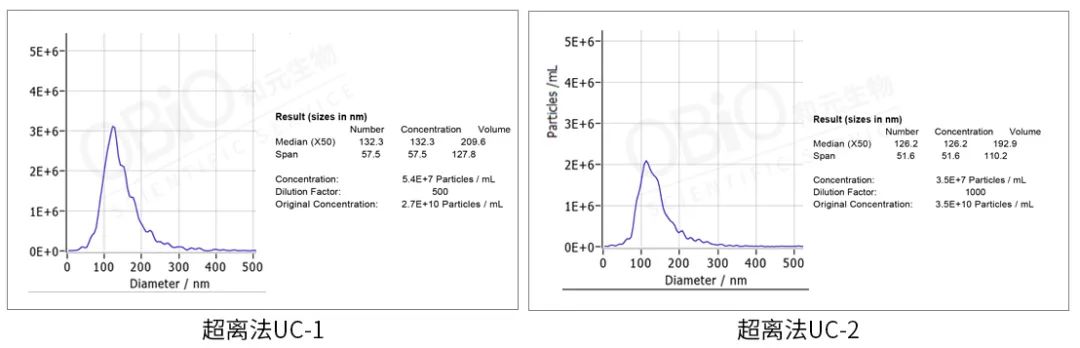
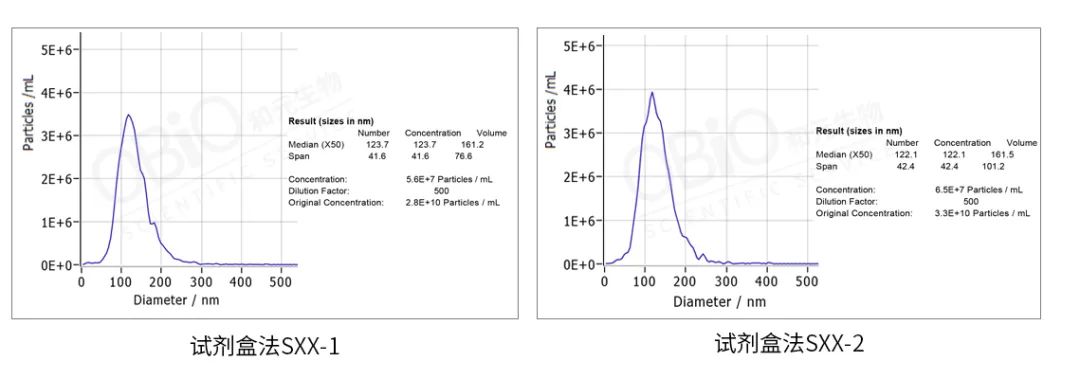
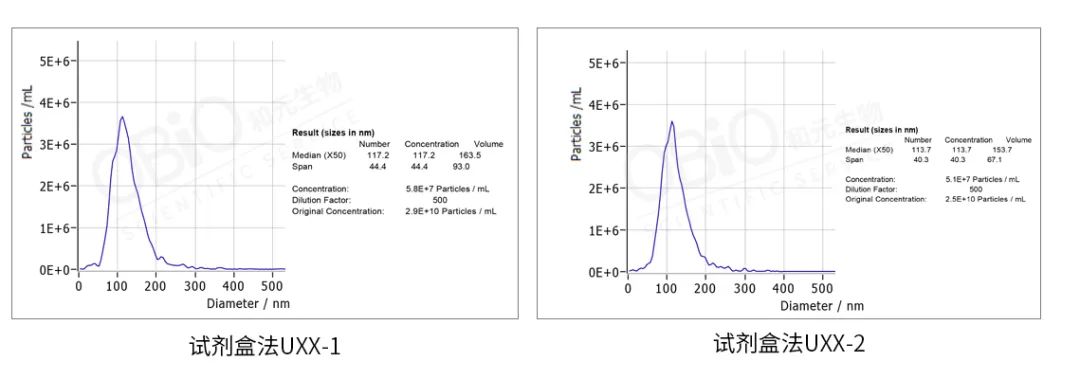
从上图结果可以看出,超离法和试剂盒法得到的外泌体大小差不多,基本在 110-120 nm,颗粒数浓度也相似,在 undefined10 的 10 次方 particles/ml 左右。
BCA 蛋白浓度测定结果:将外泌体样本进行 BCA 蛋白浓度测定,结果如下表。
| 样本名 |
BCA 浓度(ug/ul) |
| UC-1 | 0.18 |
| UC-2 | 0.14 |
| SXX-1 | 1.60 |
| SXX-2 | 1.87 |
| UXX-1 | 2.10 |
| UXX-2 | 3.10 |
WB 检测标志物:根据上述的 BCA 定量结果,制备样本,上样,做 WB。
超离法由于 BCA 测定的浓度数值低,用了最大上样量 25 ul,试剂盒法用的体积少一些,换算后每孔的蛋白总量如下:
| 样本名 |
蛋白总量 ug/孔 |
| UC-1 | 4.50 |
| UC-2 | 3.50 |
| SXX-1 | 25.00 |
| SXX-2 | 25.00 |
| UXX-1 | 25.00 |
| UXX-2 | 25.00 |
选用外泌体标志物 CD9 和 TSG101 作为本次的检测指标,实验结果如下:
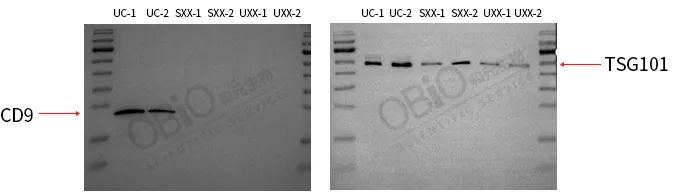
1、在 CD9 指标检测中,超离法的两个样本 UC-1 和 UC-2 尽管每孔只用了 4.5ug 的总蛋白,但是两孔中都能明显看到 CD9 的蛋白条带,而试剂盒样本 SXX-1、SXX-2、UXX-1 和UXX-2 每孔用了 25ug 蛋白,但是仍旧没有看到条带出现。
2、在 TSG101 指标检测中,上样量和 CD9 的一样,超离法和试剂盒法共 6 个孔都出现了条带,但是超离法的 UC-1 和 UC-2 条带亮度比较显著。
综合上述 BCA 数据和 WB 结果可知,虽然超离法得到的外泌体蛋白浓度较低,但是其纯度较高,基本就是真正的外泌体蛋白;而试剂盒法中虽然从 BCA 的数据来看蛋白浓度较高,但是 WB 结果说明了它的蛋白浓度并非真正的外泌体蛋白,含有很多杂质蛋白。
(三)实验结论分享
通过本次对超离法和试剂盒法效果的比较,可以发现,超离法经过多次离心步骤,可以获得纯度较高的外泌体,但是也会有一定的外泌体损失。试剂盒法虽然得到较多的外泌体,但是也有很多杂质混在一起。每种方法都有利弊,可以根据自己的需求选择合适的方法。
建议:如果做外泌体示踪、细胞功能学或动物实验,尽量选择用超离法做,一方面这类实验外泌体需求量比较大,超离法的通量较大,比较适合;另一方面这些实验对外泌体的纯度要求比较高,超离法的杂质去除相对比较干净,不至于让别人怀疑实验的其他可能性。