速看!脑组织分离外泌体终于出炉!
和元生物
外泌体(Exosomes)作为细胞分泌到胞外的一种囊泡,参与不同细胞间 DNA、RNA、蛋白质等分子的传递,起到了细胞间的通讯作用。近些年,很多学者都在探索外泌体在各个研究领域中扮演的角色和功能,但是由于外泌体的不易获得性,使得很多方向的外泌体研究举步维艰。
在神经系统中,由于脑脊液难以得到,要想获得脑部直接来源的外泌体则难度较大,所以从脑组织中分离外泌体对于神经系统研究人员迫在眉睫。
且目前外泌体的分离方法很多只适用于液体样本,不太适合直接分离组织。所以我们一直立足文献[1]并积极优化从脑组织中分离外泌体的方法。本文主要和大家分享我们从小鼠脑组织中分离外泌体的效果,供大家参考:
一、采用消化+超离法从脑组织中分离外泌体:
将脑组织剪成薄片,放入离心管中加上消化液进行消化,经水浴、反复轻轻上下颠倒,再用移液枪间断缓慢吹吸至消化结束。随后加入培养基于消化液中,混匀,置于冰上。再进行一系列的差速超速离心过程,包括除杂、滤膜过滤、超离等。最后用 PBS 重悬外泌体,用重悬后的外泌体进行下面的透射电镜(TEM)、纳米粒径跟踪分子(NTA)和 marker WB 鉴定。
二、TEM 鉴定外泌体外观:
将提取的外泌体样本置于冰盒中,使用移液枪吸取外泌体样本于铜网上静置 1 min。(用镊子夹铜网要轻,防止铜网夹破)。再将铜网上的外泌体样本吸干,使用移液枪吸取醋酸双氧铀染色液室温染色。随后将染色完成的样本放于灯下烤。样本制好后,观察拍照,保存图片。结果如下:
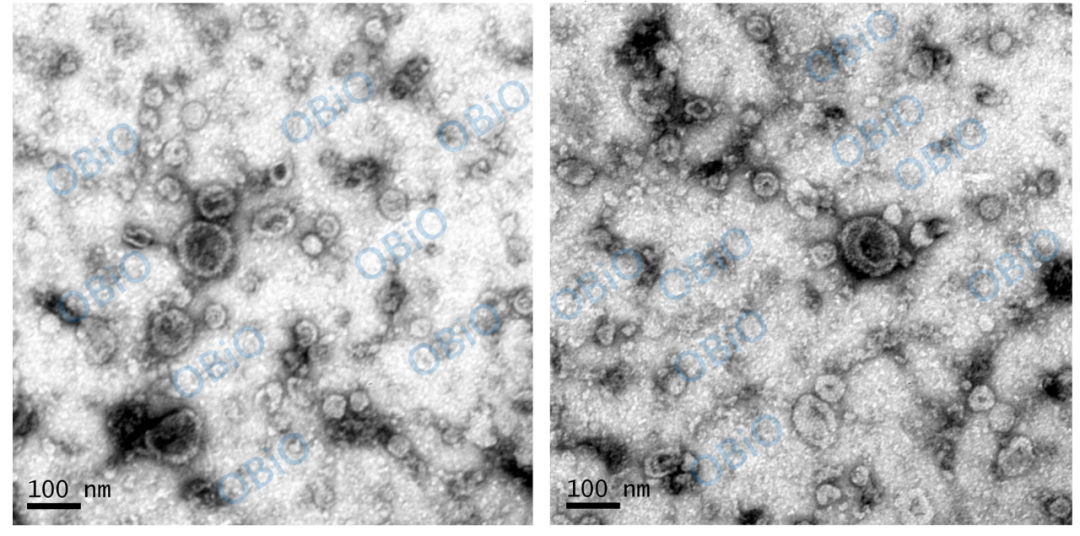
图一 TEM 鉴定脑组织外泌体形态
从 TEM 结果中可以看出,样本中有典型的外泌体结构,且数量比较多,大小不一。
三、NTA 鉴定外泌体的大小和颗粒浓度:
准备外泌体样本,并将外泌体样本置于仪器中检测。检测结果如下:
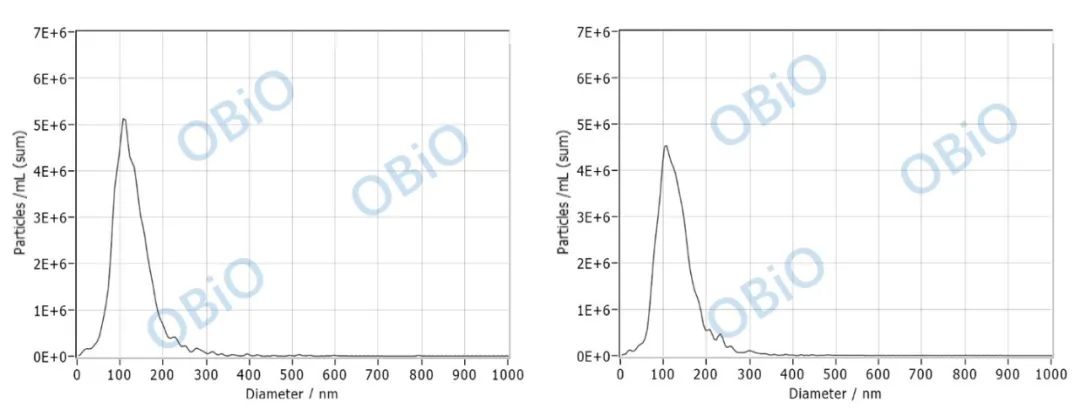
图二 NTA 鉴定脑组织外泌体大小
从 NTA 结果中可以看出,检测到的外泌体颗粒大小在 30-150nm 范围,符合外泌体的大小,且颗粒浓度在 undefined10 的 11 次方以上(由图中 particles 数乘以稀释倍数)。
四、WB 鉴定外泌体的蛋白 marker:
按照实验室常规操作进行外泌体样本的 WB 实验。本次测试选择了三个蛋白指标进行外泌体蛋白鉴定,分别为二阳一阴,即 CD9、TSG101 和 Calnexin。WB 结果如下:
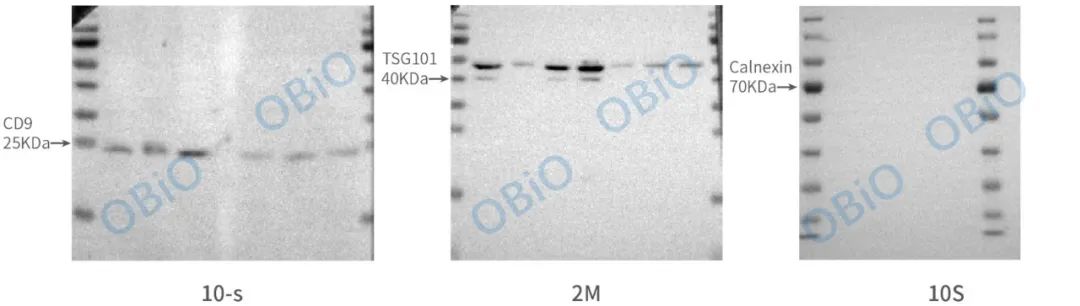
图三 WB 鉴定脑组织外泌体蛋白 marker
从 WB 结果可以看出,CD9 和 TSG101 在外泌体样本中呈现阳性结果,Calnexin 在外泌体样本中呈现阴性结果。符合外泌体的蛋白特征。
从以上三种常用的外泌体鉴定结果中可得出,本次使用的从小鼠脑组织中分离外泌体的方法是可行的,能顺利获得需要的外泌体。但是方法中也存在一些不足,从电镜结果中可以看出,样本中可能还有一些杂质掺杂。
如果要进一步除杂,可能就要面临损失很多外泌体的风险,所以经常遇到的问题是外泌体的纯度和含量很难二者兼得,这是外泌体分离目前一直存在的问题。
不止是脑组织,诸如心肌组织、脊髓组织、骨骼肌组织等都可以经消化分离出外泌体,但是过程中用到的消化液以及实验过程也会有差别,有待进一步优化和探索。也欢迎大家留言合作,一起开发新方法!
参考文献:J Extracell Vesicles. 2017 Jul 26;6(1):1348885. doi: 10.1080/20013078.2017.1348885. eCollection 2017.
