支原体污染的特点及检验(3)
互联网
网友eming43的经验
支原体的检测.
PCR法
原理 该法是通过PCR技术将支原体16srRNA基因特异性扩增,来检测培养细胞中污染的支原体。PCR引物选自16sr RNA基因上的支原体特异片段,此片段与其他细菌的序列无交叉性杂交反应。扩增产物用琼脂糖凝胶电泳,经溴乙啶(EB)染色后在紫外透射仪上进行检测。
u 16sr DNA引物用水稀释至40umol/L。
(1).正向引物:5’-ACTCCTACGGGAGGCAGCAGTA-3’
(2).反向引物:5’-TGCACCATCTGTCACTCTGTTAACCTC-3’
2) PCR扩增
(1) 在冰浴中对各样品制备PCR重要混合物,对每个样品均加入:
10X PCR缓冲液 5.0ml
25mmol/L dNTPs 混合物 0.4ul
40umol/L 16sr DNA引物 每种引物1.0ul
40umol/L pBR322 DNA 引物 每种 2.0ul
pBR322 DNA 1pg/ml 2.0ul
DNA聚合酶(5U/ml) 0.2ul
三蒸水 35.4ul
总量 45ul
(2) 用无菌去离子水稀释样品为1:10,1:100。
(3) 于每个eppendorf管中加45ul PCR扩增混合物,每管中分别加入样品原液及1:10,1:100稀释液各5ul,操作均在冰浴中进行。
(4) 在每个eppendorf管中轻轻加入50ul无菌矿物油,覆盖在液面上。如DNA扩增仪带有有制式热盖,此步骤可省略。
(5) 将各管放入DNA扩增仪的孔槽内,并执行以下循环指令:
① 950C 10min 一个循环
② 950C,30S→580C 1min→720C 1min, 共30个循环。
③ 最后720C 10min延长循环。
网友bearina的意见:
在光镜下,可以看到细胞膜上吸附很多圆点,4undefined16倍下约有0.1mm,分布多集中于细胞核周围和细胞边缘,中间部位较少。严重的整个细胞都可以看到。消化时可以看到它们从细胞膜上游离出来,很多,还会动。培养基偏碱时会大量游离。感染后细胞生长变慢,凋亡率增加,正常培养时也会出现死亡。我认为是支原体污染造成的。建议培养细胞时,如发现细胞有异常,一定要高倍镜下检测。低倍镜下一般看不出细胞的变化。
gaoyunhang认为最主要是支原体污染的发现,如果发生支原体污染,细胞营养液常常变黄,细胞生长变缓,部分细胞发生脱落等等。
如果发生了支原体污染,除非的确是极为重要的细胞,最保险的方法是将被污染细胞扔掉。
所有的对支原体污染有效的药物对细胞均有一定的毒副作用,建议不要采用。
细胞培养支原体感染
??细胞培养(特别是传代细胞)被支原体污染是个世界性问题。国内外研究表明,95%以上是以下四种支原体:口腔支原体(M.orale)、精氨酸支原体(M.arginini)、猪鼻支原体(M.hyorhinis)和莱氏无胆甾原体(A.laidlawii),为牛源性。以上是最常见的污染细胞培养的支原体菌群,但能够污染细胞的支原体种类是很多的,国外调查证明,大约有二十多种支原体能污染细胞,有的细胞株可以同时污染两种以上的支原体。
??支原体污染的来源包括工作环境的污染、操作者本身的污染(一些支原体在人体是正常菌群)、培养基的污染、污染支原体的细胞造成的交叉污染、实验器材带来的污染和用来制备细胞的原始组织或器官的污染。
??组织细胞培养工作中,主要从以下几个方面来预防支原体的污染:控制环境污染;严格实验操作;细胞培养基和器材要保证无菌;在细胞培养基中加入适量的抗生素。支原体污染细胞后,特别是重要的细胞株,有必要清除支原体,常用方法有抗生素处理、抗血清处理、抗生素加抗血清和补体联合处理。支原体最突出的结构特征是没有细胞壁,一般来讲,对作用于细胞壁生物合成的抗生素,如 -内酰胺类、万古霉素等完全不敏感;对多粘菌素(polymycin)、利福平、磺胺药物普遍耐药。对支原体最有抑制活性及常用于支原体感染治疗的抗生素是四环素类、大环内酯类及一些氟喹诺酮;其他类抗生素如氨基糖苷类、氯霉素对支原体有较小抑制作用,所以常不用来作为支原体感染的化学治疗剂。InvivoGen公司研究开发的新一代支原体抗生素M-Plasmocin能有效地杀灭支原体,不影响细胞本身的代谢,并且用M-Plasmocin处理过的培养细胞,不会重新感染支原体。
1、支原体肺炎的首选药是红霉素和四环素(副作用多,已少用)。所以用红霉素是有道理的。但是,由于耐药菌的泛滥,红霉素耐药菌非常多,所以有人发现红霉素无效(当然可能根本不是支原体污染),要不可以试试四环素,用的人少,耐药菌还是要少一些的,然而,红霉素和四环素都是抑菌剂,所以不能断根,这就是我下面要谈的。
2、对支原体有效的杀菌剂还是氨基甙类,即使只有中度敏感。这里面就有一个问题,很多人又用庆大霉素又用卡那霉素,我不知道这是为什么?他为什么不再加上链霉素和妥布霉素?协同作用是由不同机制的药物合用产生的,同一机制药物的作用仅等同于增加其中某种药物的剂量而已,有什么意义呢?所以我觉得用一种就够了。庆大霉素不错,但耐药菌也常见,所以有时可能还是没效果。丁胺卡那是这类药中较少产生耐药性的,可以试试吗?
3、谈谈合用的问题。我推荐抑菌剂+杀菌剂:红霉素/四环素+庆大霉素/丁胺卡那霉素,我个人认为四环素+丁卡可能最为有效,因为相对而言,细菌对他们都教陌生、敏感。但是还不够,请往下看。
4、谁都不敢保证这样就万事大吉了。里面有一小撮细菌可能还能顽强抗过去,它们的后代必将变异为耐药菌。所以还应该加点其他的措施,因为这些细菌量毕竟少,消化后的悬浮细胞离心一下,细胞毕竟比支原体重,是不是可以分离出来?多次稀释细胞并离心是否可以很大程度的减少支原体的数量呢?当然,前提是用了一到两次抗生素细菌只有少量了。
5、再不行,复苏吧。
我们实验室所有细胞都有支原体污染,而且从上个学期以来越来越严重了。本来上个学期细胞生长还比较快,而实验室负责细胞房管理和复苏细胞、配培基的老师看了以后也总说没关系,因此一直没在这事上下工夫,细胞长得太糟我就用D-Hanks洗两次,然后用酶消化后用灭菌的离心管洗细胞、1000rpm离心,三次,同时用D-Hanks洗两次培养瓶,重新贴壁,似乎也有一点点效果。但这个学期要用的几种细胞中有的过了两个星期也长不起来,长起来的细胞周围也有很多沙子样的小黑点,全实验室所有养了细胞的都说自己的细胞长得差,负责细胞房工作的老师复苏了一次又一次,这方面的问题还是没有人着手解决,我急了,查了支原体方面的文献,有些文章比较麻烦,注射到小鼠体内来杀灭支原体,至少这在我们实验室是不可能使用的方法;有些文章是联合使用两种抗生素来清除支原体,简单方便,我就试了这种。
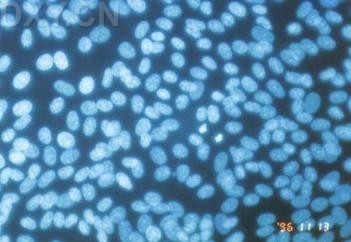
关于检验支原体污染,有PCR法、培养法、DNA荧光染色法,我选择的是DNA荧光染色法,将冰醋酸和甲醇按1:3混合,固定细胞两次,每次10分钟,然后用1μg/ml的Hoechst33258染色20分钟,紫外激发,确认了我的细胞中生长最好的都有支原体污染。于是我花1.5元买了环丙沙星(ciprofloxacin)药片,稀释成50μg/ml,离心去除淀粉之类的不溶性辅料,加入培基中,稀释成10μg/ml,跟正常培基一样用法,打算处理12天后再用Hoechst33258染色验证,对于污染严重的再用1μg/ml四环素处理3天。我前两天试的,每种细胞分成两瓶,一瓶用加ciprofloxacin的培基,一瓶不加,对比明显,效果不错,但要完全消除还需要一些天。我向同学推荐了这个方法,有人说自己的培基前段时间已经加了青霉素,但好象没有效果,支原体没有细胞壁,这类干扰细胞壁合成的抗生素当然对其没有效果;有的同学试了,细胞变得漂亮多了,原来牢牢贴在瓶壁上的黑点也去掉了。呵呵,俺的那些细胞现在是越长越标致了。
下图是支原体污染细胞的Hoechst33258染色结果。
细胞一旦污染支原体,留之又不能,弃之又可惜,所以总要想一些补救措施,现将我所知道的与各位交流一下。
1)化学药物——在上面讲了很多了
2)抗血清处理——特异性多抗
3)6-甲基嘌呤脱氧核敢(6-MPDR)有限稀释法
4)激活巨噬细胞的应用——可在24孔板内每孔加入1ml饲养细胞20万/ml,使形成巨噬细胞单层,再加入所培养的细胞。巨噬细胞培养基中加入四环素、红霉素、tylosin或林可霉素等抗生素,可消除污染
5)克隆法——有限稀释法,是将细胞稀释接种96孔板中,使每孔接种一个细胞,挑取无污染的单个克隆,此法对污染较轻的细胞株有比较好的效果。
6)加热法——利用软琼脂技术,50度加热灭活细胞的支原体,再于37度1-3天培养,使琼脂中的抗生素与支原体进一步作用。
7)小鼠体内传代除去支原体污染——被支原体污染的特异性杂交瘤细胞可接种鼠腹腔中传代,待长出肿瘤后取出接种小鼠,如此反复2-3次,可有效清除。这种方法在实际单抗制备杂交瘤污染时特别适用。
zxcvbmumu试过了,使用终浓度为10ug/ml的乳酸环丙沙星注射液,可以抑制细胞间的黑点,并使细胞恢复增殖活性,但是好像不能完全去除黑点,谢谢前面讲这一方法的所有发帖者!