高效液相色谱―电喷雾串联质谱法测定蔬菜中虫酰肼和甲氧虫酰肼残留
互联网
【摘要】 建立了蔬菜中虫酰肼和甲氧虫酰肼的高效液相色谱�电喷雾串联质谱 (LC�ESI�MS/MS)检测方法。样品经碱性乙腈提取,固相萃取净化,反相高效液相色谱柱分离后进行质谱分析。在选择反应监测模式(SRM)下进行特征母�子离子对信号采集。分别以碎片离子m/z 297和m/z 149进行外标法定量。虫酰肼和甲氧虫酰肼残留的检出限(S/N=3)为 1.0 μg/kg,加标回收测得定量限为 4.0 μg/kg; 在5.0~200 μg/L时峰强度与质量浓度的线性关系良好(r2>0.996)。在4.0、10.0和20.0 μg/kg 3个添加水平,通过基质曲线校正后,虫酰肼和甲氧虫酰肼的平均回收率范围为90%~110% 和70%~80%;相对标准偏差小于8%。结果表明,该法简单、灵敏,适用于蔬菜中虫酰肼和甲氧虫酰肼残留的分析确证。
【关键词】 高效液相色谱�电喷雾串联质谱法,残留,虫酰肼,甲氧虫酰肼,蔬菜
1 引 言
虫酰肼(tebufenozide, 米满)和甲氧虫酰肼(methoxyfenozide, 美满)是新一代双酰肼类昆虫生长调节剂,可诱使鳞翅目害虫过早蜕皮、成熟,使昆虫发育不完全并且在几天后死亡,从而相对地快速抑制昆虫进食[1]。这两种农药在我国蔬菜生产中广泛使用,但由于国内没有及时建立相应地残留检测方法,在蔬菜出口时已发生因超标而导致的经济损失。为此,建立了虫酰肼和甲氧虫酰肼在常见蔬菜中残留量的高效液相色谱�串联质谱法检测方法。目前国内已有的检测方法多为高效液相色谱法[2~4],所需时间长,并且阳性结果不能确证。相比之下,高效液相色谱�串联质谱法快速有效,并且具有较好的稳定性。文献[5]报道用 LC�MS/MS 方法检测水果蔬菜中的甲氧虫酰肼残留,但该方法采用液液分配净化样品,消耗有机溶剂量多,且操作麻烦。相比之下,固相萃取法快速高效,适用于日常的样品检测。
本实验通过碱性乙腈提取,固相萃取净化,反相高效液相色谱柱分离后, 利用串联质谱选择反应监测(SRM)模式的选择性和特异性,建立了蔬菜中虫酰肼和甲氧虫酰肼的定性定量液相色谱�串联质谱检测方法,讨论了质谱解离的可能机理。
2 实验部分
2.1 仪器与试剂
Surveyor液相色谱系统(Thermor 公司); Quantum Ultra三重四极杆串联质谱(Thermo�Finnigen 公司);真空氮气吹干仪(Zymark公司);MilliQ去离子水发生器(Millipore公司);12通道半自动固相萃取装置(Supleco公司)。虫酰肼和甲氧虫酰肼标准品,纯度为>95%(Sigma公司);甲醇,色谱纯(Merck公司);活性炭小柱,250 mg/3 mL(Supelco公司)。实验用水为去离子水。
2.2 标准溶液配制
准确称取虫酰肼和甲氧虫酰肼标准品各10.0 mg(精确到0.01 mg),至10 mL容量瓶,用甲醇稀释至刻度,得1.0 g/L 贮备溶液,于-18 ℃避光存放。再用甲醇逐级稀释至1.0 mg/L(于4 ℃保存4星期),绘制校准曲线时用流动相逐级稀释至5.0、10.0、20.0、50.0、100.0和200.0 μg/L工作溶液。
2.3 样品提取和净化
称取5.00 g 新鲜蔬菜样品置于离心管中,加入4 mL 0.1 mol/L NaOH 溶液,15 mL 正己烷饱和过的乙腈,混匀后超声10 min,离心后取上层清液过滤至干净离心管。再加8 mL 正己烷饱和过的乙腈于蔬菜样品中同前再提一次,上清液仍过滤至离心管。过滤结束后,加 4 mL 乙腈淋洗滤纸。往离心管中加适量的NaCl固体,涡旋离心,使乙腈与水分层。吸出上层有机相至平底烧瓶,40 ℃ 旋转蒸发至干加入3 mL正己烷溶解样品,待过柱。用 3 mL丙酮洗活性碳小柱,流完后抽干。再加 3 mL 正己烷平衡小柱,在正己烷流尽之前上样,同时接收上样液。再次抽干后加 5 mL V(正己烷)∶V(丙酮)=8∶2的混合溶液洗脱,控制液体流速不超过1 mL/min,并接收洗脱液。将含有对应上样液及洗脱液的接收瓶置于氮吹仪上50 ℃水浴吹干。残渣用1.00 mL50%甲醇水溶液溶解,经0.45 μm水相和有机相滤膜过滤,滤液待测。
脱水蔬菜样品,粉碎后称样,加乙腈提取两次,旋转蒸发,其余步骤同上。样品加标实验:称取样品后加入适量虫酰肼和甲氧虫酰肼混合标准溶液混匀,室温下放置10 min,加入提取溶液,其它步骤同上。
2.4 色谱质谱条件
SunFire 系列C18反相色谱柱(150 mm×2.1 mm×3.5 μm,Waters公司),柱温:室温,流动相:0.1%甲酸溶液(A)和甲醇(B),梯度洗脱程序:0 min时20%B; 0~3.0 min线性增加至90%B; 3~8.2 min 90%B; 8.2~8.5 min降至20%B,之后进行系统平衡。流速:0.25 mL/ min,进样量:20 μL。
ESI电离源:正离子检测模式;离子源温度360 ℃;电离电压4.8 kV;雾化气和气帘气:N2;流量:1.6 L/min;辅助气:N2, 流量:17 L/min。监测模式:采用SRM模式。选择母离子(Q1)/子离子(Q3)离子对及其碰撞能量见表1.表1 虫酰肼和甲氧虫酰肼的选择监控离子及碰撞能量
2.5 液质联用测定
将虫酰肼和甲氧虫酰肼的混合标准工作溶液用流动相逐级稀释为系列标准溶液,与处理过的样品溶液依次等体积进样。虫酰肼和甲氧虫酰肼分别以碎片离子m/z 297和149进行外标法定量分析。
3 结果与讨论
3.1 样品前处理的优化
用正己烷饱和过的乙腈作为提取溶剂,它利于盐析分层,提高了虫酰肼和甲氧虫酰肼在乙腈层的分配比例。实验通过对比正己烷饱和过的乙腈和未饱和乙腈的提取效率表明,前者的回收率比后者提高了约30%。过滤步骤中滤纸对虫酰肼和甲氧虫酰肼有一定的吸附作用,造成回收率的不稳定或偏低。在实验过程中增加了淋洗滤纸的步骤来提高回收率。
由于像菠菜等绿叶蔬菜常含有大量色素,溶剂提取完以后颜色很深。如果在旋转蒸发后直接定容进样,色素容易残留在仪器内造成污染,并且,杂质含量会降低信噪比,影响定量的准确性,样品需要过活性炭小柱净化。固相萃取净化时,在用正己烷溶解样品上样时,有部分样品会随上样液流出。在洗脱步骤中,比较了V(正己烷)∶V(丙酮)=8∶2、6∶4 和4∶6 三种的混合液作为洗脱液,发现在正己烷比例较高时有较好的回收率,并且信噪比较高。实验中选择用V(正己烷)∶V(丙酮)=8∶2混合液洗脱,同时收集上样液和洗脱液。
白花菜中加标提取的虫酰肼和甲氧虫酰肼选择离子质量色谱图如图1所示。 图1 虫酰肼(A)和甲氧虫酰肼(B)样品加标的选择离子质量色谱图
Fig.1 LC�ESI�MS/MS chromatograms of
tebufenozide (A) and methoxyfenozide (B) in the spiked sample
3.2 MS/MS条件和解离机理
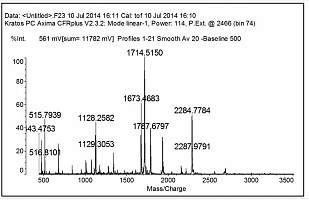
根据欧盟EC/657规定,利用质谱方法对药物残留进行确证,必须满足4个识别点的要求,同时特征离子的丰度比要和标准物基本一致。对于串联质谱一个母离子(1点)加两个特征子离子(1.5点×2)可以满足质谱确证的需要。虫酰肼和甲氧虫酰肼的特征离子对分别为353/297、353/133和369/313、369/149,加标样品中残留物的特征子离子的丰度比与标准物基本一致,满足质谱方法对药物残留的确证要求。具体的质谱图如图2所示。
根据实验结果质谱图,以虫酰肼为例研究了其药物解离的可能机理,结果如图3所示。甲氧虫酰肼因为其结构与虫酰肼相似,故应该具有类似的解离机理。
图2 标准物虫酰肼(a)和甲氧虫酰肼(b)的质谱图
Fig.2 MS spectra of standards of tebufenozide (a) and methoxyfenozide (b)图3 虫酰肼母离子和子离子及质谱裂解机理
Fig.3 Reaction process of the tebufenozide precursor ion and product ions3.3 线性范围、标准曲线和检出限
虫酰肼和甲氧虫酰肼在5.0~200 μg/L内线性良好,线性方程分别为y=928601x-563640和y=1439740x-575171,相关系数分别为0.9962和0.9991;根据信噪比(S/N=3)计算,检出限为1.0 μg/kg。通过阴性蔬菜加标测定,方法的定量限为4.0 μg/kg。
3.4 回收率和精密度
虫酰肼和甲氧虫酰肼样品添加实验选择4.0、10和20 μg/kg 3个浓度水平进行加标回收,分别以碎片离子m/z 297和m/z 149进行外标法定量。实验发现,菠菜、葱和白花菜等蔬菜都有基质抑制效应。表2 方法的添加回收结果和精密度Recovery51.2113.841.291.540.280.336.773.3RSD(%)7.83.84.54.0 4.0和20 μg/kg加标水平的实验数据和校正后的统计结果如表2所示。可见,校正过后,虫酰肼的回收率为90%~110%,而甲氧虫酰肼的回收率在70%~80%,RSD小于8%,可满足日常分析的需要。
【参考文献】
1 Feng Jian(冯 坚). Modern Agrochemicals(现代农药), 2004, 3(2): 4~8
2 Mao Jiang�Sheng(毛江胜), Zhao Shan�Cang(赵善仓), Deng Li�Gang(邓立刚). Agrochemicals(农药), 2006, 45(2): 121~122
3 Zhang Hu(章 虎), Wu Li�Qin(吴俐勤), Xie Lei(谢 磊), He Hong�Mei(何红梅), Zhu Jia�Hong(朱加虹). Modern Scientific Instruments(现代科学仪器), 2006, 3: 55~58
4 Ji Jin�Zhong(季锦忠). Modern Agrochemicals(现代农药), 2004, 3(1): 22~24
5 Hall G L, Engebretson J, Hengel M J, Shibamoto T. J. Agric. Food Chem., 2004, 52: 672~676
![9-(溴甲基)丫啶[用于高效液相色谱标记],1556-34-9,≥98%(HPLC),阿拉丁](https://img1.dxycdn.com/p/s14/2024/0619/381/2760431817860733081.jpg!wh200)