DNA重组(限制性酶切和连接)
互联网
学习目标:学习和掌握重组DNA的酶切、连接以及鉴定重组子的基本原理与实验技术方法。
学习内容:质粒DNA和目的DNA的酶切、 琼脂 糖凝胶电泳、质粒DNA和目的DNA的连接、感受态细胞的制备及重组DNA的转化、重组子的筛选。
学习任务与要求:课前预习、课后总结;认真完成每一步实验操作,详细记录实验现象和结果并加以分析。
实验时间安排表:
| 时 间 | 实 验 内 容 |
| 第一天:8:00-8:30 | 准备限制性酶切反应体系 |
| 8:30-10:30 | 370C酶解3小时 |
| 10:30-13:00 | 纯化酶切载体和目的基因 |
| 13:00-14:00 | 琼脂 糖凝胶电泳 |
| 14:00-14:30 | 准备连接反应体系 |
| 14:30-第二天8:00 | 140C连接过夜 |
| 16:30-第二天8:00 | 预培养过夜 |
| 第二天:8:00-8:30 | 将过夜培养的菌液接入新的LB培养基中 |
| 8:30-11:30 | 菌液培养2.5-3小时 |
| 11:30-12:30 | 菌液冰浴保存、午饭 |
| 12:30-14:00 | 感受态细胞的制备 |
| 14:00-15:00 | 质粒DNA的转化 |
| 15:00-17:00 | 复苏、铺Amp抗性平板、复苏细胞涂平板和培养过夜 |
| 第三天早晨8:00 | 观察结果(抗性平板上生长起来的菌体) |
| 16:30-第二天8:00 | 预培养过夜 |
| 第四天:8:00-11:30 | 质粒DNA的提取 |
| 12:00-15:00 | 质粒DNA的双酶切 |
| 15:00-16:30 | 琼脂糖凝胶电泳、观察结果 |
实验的常见问题、关键问题及难点:
微量操作、酶切体系的合理性、酶切是否完全、连接效率和转化效率、感受态细胞的质量
可能的实验结果:
|
图1 |
图2 |
图3 |
上图显示了不同同学的蓝白斑筛选结果。只有转入了外源质粒的菌株才可以在含有Amp的培 养基上生长,所以只要有菌落生长,无论是白斑和蓝斑都说明转化是成功的。但白斑不一定就是阳性重组子,因为实验中将生色底物x-gal涂于培养基表面,并 不能保证每个区域都涂满了x-gal,没有生色底物的地方不管是阳性还是阴性菌落都不会显蓝色,所以有一部分的白色菌落是假阳性需要进一步验证。
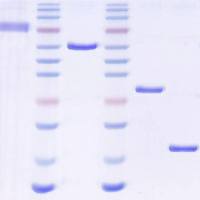
|
|
|
上图显示了将白斑小提质粒后的电泳鉴定结果。图1和图2是不同的同学的筛选结果。图的上 半部分为提取质粒后直接电泳结果,下半部分为进行了双酶切后的电泳结果。从图中可以看出不进行酶切前重组质粒由于分子量较大而电泳迁移率较小。而双酶切 后,由于重组质粒会被酶切成外源基因与质粒两个分子所以电泳时会有两条带,而非重组质粒则只有一条带。
造成重组失败的原因主要有:(1)质粒酶切不完全。虽然我们在酶切质粒后会电泳鉴定一下质粒是否变成单一的线性分子,但如果质粒只被单一的酶切开我们在电 泳时看到的也是线性的分子,而在连接时我们无法将带有单一切口的质粒与外源基因相连,质粒本身却可以重新连接成环型分子,并没有重组。(2)连接反应失 败,外源基因不能与质粒分子重组成新的质粒分子。(3)转化不成功。可以做一个转化空载体的对照实验消除这方面的因素。(4)极少数情况下发生外源基因之 间或质粒之间串联。