实验90 离子交换凝胶柱层析
互联网
实验90 离子交换凝胶柱层析
原理
在植物生理生化的研究中,往往要从一个组分复杂的混合物中,将性质很相近的生物大分子分离,这是研究工作中一个很关键的问题,需要一种具有高度分辨力的技术,才能满足这一要求。离子交换层析就是这样的技术,能够分离只有很小差异的物质(例如仅有一个氨基酸不同的两种蛋白质),是分离生物大分子的一种重要方法。由于差不多所有的生物大分子都是极性分子,都带有电荷。离子交换层析的基本原理即基于溶质分子所带的电荷,能使所带电荷稍有不同的分子分离。
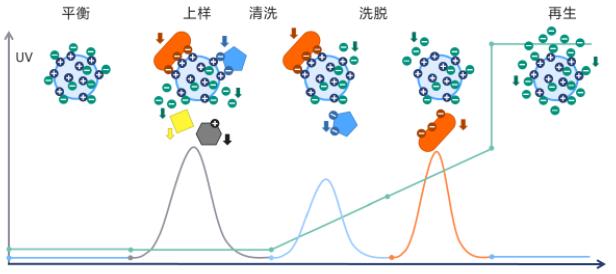
进行离子交换层析的过程有两个主要阶段:第一阶段是加样和产生吸附作用过程,未被吸附的物质则从柱床上流失;第二阶段是物质从柱子上洗脱,彼此得到分离。发生分离作用是由于不同物质所带电荷不同,对离子交换剂有着不同的亲和力,亲和力的大小可以通过改变条件而加以调节,如通过改变离子强度和pH。
制备层析柱
1.选择离子交换剂
离子交换剂的种类很多,根据交换剂的功能基团可分为阳离子交换剂和阴离子交换剂,阳离子交换剂又分强酸型(如乙基磺酸,SE;丙基磺酸,SP),弱酸型(如羧甲基,CM)。用离子交换剂也有强碱型[二乙基—(2—羟丙基)氨基乙基,QAE],弱碱型(二乙基氨基乙基,DEAE)。由于交换剂的母体(matrix)不同,又有树脂、纤维素、葡聚糖凝胶和琼脂糖凝胶等类型。没有一种交换剂对所有物质的分离都是适用的,所以工作开始首先要选定交换剂的类型。要选择交换剂首先应根据分离物质的性质,例如要分离纯化酶,酶是一种蛋白质,蛋白质为两性物质,由于外界环境的pH不同,所带的电荷也不同。当pH值低于等电点时,蛋白质带正电荷,能结合在阳离子交换剂上,此时应选用阳离子交换剂;pH高于等电点时,带负电荷,无疑应选用阴离子交换剂。此外,还应考虑蛋白质的变性、酶的失活等,如果该酶在低pH时不稳定,这样就只能在高于等电点的PH条件下,选用阴离子交换剂进行分离,而不能在低于等电点的PH条件下,用阳离子交换剂进行分离。一般情况下分离的起始缓冲液的PH值总是高于或低于等电点1pH单位(此时应高于等电点1pH)。如果要分离的酶的等电点在文献上查不到,则可以通过简单的试验,确定起始缓冲液的pH值,其方法为:
(1)取试管数支,每管中加入0.1g葡聚糖凝胶离子交换剂(或其他类型离子交换剂)。
(2)各管用0.5mol/L缓冲液10ml使吸胀,然后用缓冲液洗10次,每次10ml,如为阴离子交换剂则所用缓冲液的pH范围为5─9,阳离子交换剂则用pH4─8,pH间距为0.5。
(3)用离子强度较低(0.01─0.05mol/L)pH值相同的缓冲液洗各管中的交换剂凝胶5次,每次10ml,使交换剂平衡稳定。
(4)在每管中加入一定量的样品(如要纯化的酶液),摇动试管5─15分钟,放置待胶粒下沉。
(5)取每管中的上清液进行分析(测定酶活性)。假如出现图40所示结果,在pH6.0─6.5之间酶蛋白被交换剂结合,这种情况下,起始缓冲液的pH应选用6.5,在该pH下被结合的蛋白质更容易从交换剂上释放,如果选用更高的pH,会给以后从交换剂上洗脱带来困难。
此外,还应该考虑交换剂的颗粒大小以及它的硬度,这些都会影响洗脱液的流速。交换剂的孔度虽然不会影响交换的机理,但因位于交换剂内部的功能基团,对大分子物质来说就无法利用,这样就会影响交换容量。另外,还应考虑样品的分子量,如分子量小于106 ,可选用SephadexC─25或A—25;分子量在104 ─105 之间,则可选用SephadexC—50或A—50,或Sepharose(琼脂糖凝胶)、Sephacel(微晶纤维素);分子量大于105 ,选用Sepharose或Sephacel都是合适的;对于很大的分子,如分子量超过4×104 ,可用SephadexC—25或A—25,因为它们的微珠最小,在胶粒的表面,可取代的功能基团最多,有利于大分子物质在胶粒表面发生离子的交换。
2.选择缓冲系统
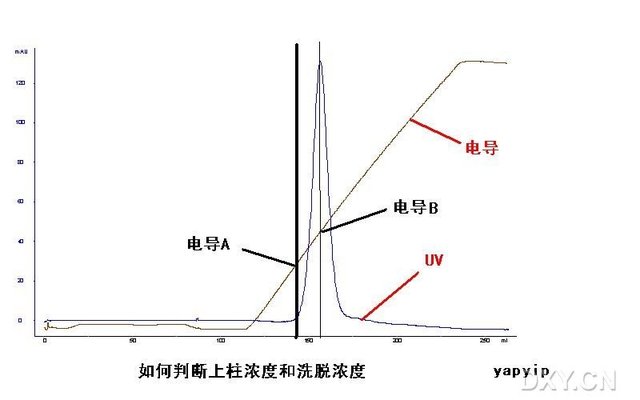
对于一个缓冲系统来说要考虑的是缓冲成分、离子强度及pH值。如果缓冲离子带的电荷与交换剂功能基团的电荷相反,它们将参与离子交换过程,使局部的pH发生变化。所以阴离子交换剂要用阳离子缓冲液(如Tris、吡啶、咪唑、铵、乙二胺、烷基胺、氨基乙醇等缓冲液);阳离子交换剂则用阴离子缓冲液(如醋酸、柠檬酸、甘氨酸、磷酸以及巴比妥等缓冲液)。缓冲液的离子强度影响结合能力,离子强度低时对交换剂功能基团的竞争结合能力弱,所以蛋白质与交换剂的结合较强,增加离子强度则增加竞争作用,降低了交换剂与蛋白质的结合能力,结果将蛋白质从交换剂上洗脱。洗脱液的离子强度也可以通过试验确定(与上述选择起始缓冲液pH值的试验相似,用选定的起始缓冲液pH,以2 梍5×10-1 1mol/L NaCl进行测定)。当离子强度为0.1,pH处于等电点±0.5时,则该物质开始从离子交换剂上解离。
3.装柱、洗脱分离
层析柱的质量直接影响分离的效果,质量差的柱子会降低分辨能力,使峰变宽,流速不稳。在装柱过程中应特别注意不能有气泡进入,产生死体积,以避免已分离的组分重新混合。所以吸胀后的交换剂和配好的缓冲液,应该用真空泵抽除空气。交换剂凝胶用起始缓冲液充分吸胀(吸胀1梍2天),如果交换剂凝胶是瑞典Pharmacia Fine Chemicals产品,直接用缓冲液吸胀即可。如果不是盐式剂型则需要事先用酸和碱作预处理,处理时避免剧烈搅动。柱子装好后至少要用2倍柱床体积的缓冲液流过交换剂,使达到平衡和稳定。样品中离子的组成应该与起始缓冲液相同,如果不同,可以通过在起始缓冲液中透析使其达到一致。如果以后用起始缓冲液洗脱,则加在柱上的样品量一般为柱床体积的1梍5%。如果用梯度溶液洗脱,则应使样品的重要组分,在柱子顶端被吸附,这时样品中组分的含量较样品的体积更为重要,大体积的稀样品不必经过浓缩就可以直接加到柱子上。
在通常情况下可用常液洗脱(即用起始缓冲液洗脱),这是最简单而方便的洗脱方式,不需要梯度仪,但分离的时间长些,分离效果也较差。目前用得更多的是浓度梯度洗脱,在洗脱过程中改变离子强度。前面已经提到过,增加离子强度则增加与交换剂上功能基团的竞争作用,降低了交换剂与样品组分的结合能力,结果将组分从交换剂上洗脱,浓度梯度洗脱方式可以提高分离的效果,也可缩短分离的时间。提高离子强度通过梯度装置(仪)连续不断地在缓冲液中加入浓度较大的NaCl来实现。用部分收集器将分离后的不同组分,分别收集在试管中,然后测定(如测定蛋白质含量或酶活性等)各试管中存在的各个组分。层析装置如图41所示。
4.层析柱的再生
经过层析分离后往往会有一些杂质污染交换剂凝胶或柱床的表面,必须处理除去。上样前应将样品离心或过滤,除去样品中的不溶物,以免污染柱床表面。对于已沉积于柱床表面的不溶物,可人工挖去表层交换剂,再适当补充一些新的。蛋白质、脂类等对交换剂的污染,可分别用0.1mol/L NaOH和1mol/L NaCl洗涤,再用蒸馏水洗至中性,然后用缓冲液平衡。洗涤过程一般可在层析柱中进行。暂时不用的交换剂,加缓冲液制成悬液,加入防腐剂,如0.02%叠氮钠、0.001%醋酸苯汞等,在冰箱中可贮藏一年左右。如用过的交换剂数量较大,则可进行干燥后保存。