实时定量PCR技术综述
互联网
1565
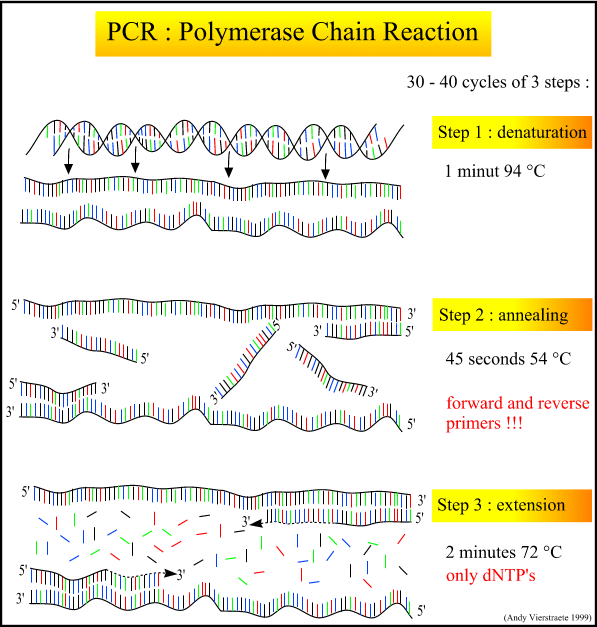
1.PCR反应动力学
右图为PCR反应曲线(横坐标为循环数,纵坐标表征产物量),不同的曲线代表初始模板量不同的 PCR反应。PCR反应的动力学公式为:
C n =C 0 (1+E) n
其中C 0 和C n 分别为初始模板和n循环的拷贝数,n为循环数,E为扩增效率(0≤E≤1),理想状态下(即每个循环中所有模板均与引物结合并等到扩增),E为1。
2.定量PCR原理
定量PCR是将待测标本与一系列浓度(C 0 )已知的标准品在同一条件下共同扩增,并进行实时检测,根据标准品的检测值及已知的C 0 值作出标准曲线,如右图(横作标为的C 0 对数值),再根据待测标本的检测值在标准曲线上查到待测标本的C 0 值。
3.信号产生
目前定量PCR技术信号产生都是基于FRET (fluorescence resonance energy transfer)的原理,即在一定波长的光激发下,一个荧光基团A发光,并且被邻近的另一个荧光基团B吸收,使荧光基团B发光。如检测荧光基团A,应在FRET消除后;如检测B,则应在FRET发生时检测。
根据信号产生方式的不同可将定量PCR技术分为三类:TaqMan Probes技术;Hybridization Probes技术;Molecular Beacons技术。
TaqMan Probes技术(右图A)是Perkin Elmer公司1995年研制,利用热稳定DNA聚合酶5’→3’外切酶活性,将TaqMan 探针5’端荧光基团切去,使之与3’端荧光基团分离、荧光淬灭消失,在特定波长下检测5’端荧光基团即可表征PCR产物的量。
右图为PCR反应曲线(横坐标为循环数,纵坐标表征产物量),不同的曲线代表初始模板量不同的 PCR反应。PCR反应的动力学公式为:
C n =C 0 (1+E) n
其中C 0 和C n 分别为初始模板和n循环的拷贝数,n为循环数,E为扩增效率(0≤E≤1),理想状态下(即每个循环中所有模板均与引物结合并等到扩增),E为1。
由上图可知,只有在线性区段E值才为定值,这样才能通过检测C n 定量C 0 ,由于终点检测不能保证在线性区段,所以重复性不好,实时检测(每个循环检测一次)技术解决了这个问题。
2.定量PCR原理
定量PCR是将待测标本与一系列浓度(C 0 )已知的标准品在同一条件下共同扩增,并进行实时检测,根据标准品的检测值及已知的C 0 值作出标准曲线,如右图(横作标为的C 0 对数值),再根据待测标本的检测值在标准曲线上查到待测标本的C 0 值。
3.信号产生
目前定量PCR技术信号产生都是基于FRET (fluorescence resonance energy transfer)的原理,即在一定波长的光激发下,一个荧光基团A发光,并且被邻近的另一个荧光基团B吸收,使荧光基团B发光。如检测荧光基团A,应在FRET消除后;如检测B,则应在FRET发生时检测。
根据信号产生方式的不同可将定量PCR技术分为三类:TaqMan Probes技术;Hybridization Probes技术;Molecular Beacons技术。
TaqMan Probes技术(右图A)是Perkin Elmer公司1995年研制,利用热稳定DNA聚合酶5’→3’外切酶活性,将TaqMan 探针5’端荧光基团切去,使之与3’端荧光基团分离、荧光淬灭消失,在特定波长下检测5’端荧光基团即可表征PCR产物的量。
Hybridization Probes技术(右图B)是Roche公司建立的,PCR反应退火过程中,两个探针与模板杂交(相邻一个碱基),发生FRET,这时检测第二个荧光基团即可表征PCR产物的量。Hybridization Probes技术要求热稳定DNA聚合酶不具备5’→3’外切酶活性,而是在引物延伸过程中被取代,使探针可在下一循环再与模板杂交,如探针被降解,可导致定量不准。
Molecular Beacons技术(上图C)利用茎环结构的探针,当形成茎环结构时,发生荧光淬灭,退火过程中,探针与模板杂交,荧光淬灭消失,在特定波长下检测5’端荧光基团即可表征PCR产物的量。