PCR技术综述
互联网
前言
一滴残留在裙子上的精液使得美国总统Bill Clinton不得不坦承他与白宫实习生有不正当的关系。因为他知道现在的生物科技就连一个精子也能被用来做为证据。这种将极微量的生物标本化为可供鉴定的现代技术正是PCR (Polymerase chain reaction)--聚合酶链式反应具有的特色之一。这也是分子生物医学令人震撼的一例。
何谓PCR
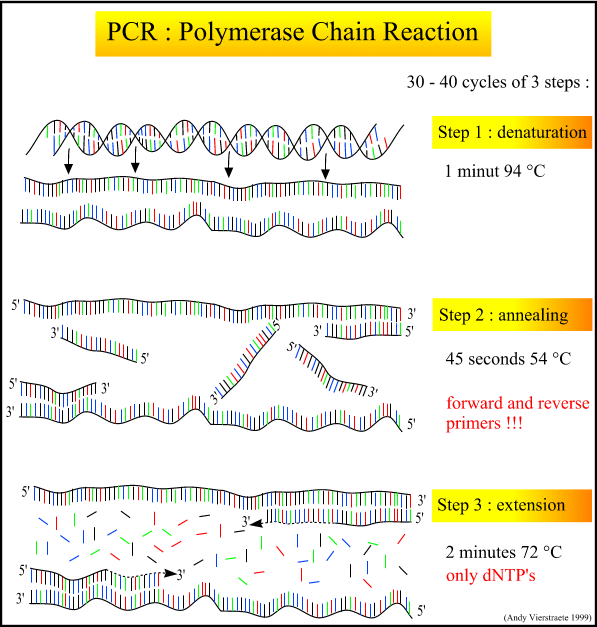
简单的说,PCR 就是利用DNA 聚合酶对特定基因做体外或试管内 (In Vitro) 的大量合成。基本上它是利用DNA 聚合酶进行专一性的连锁复制.目前常用的技术,可以将一段基因复制为原来的一百亿至一千亿倍。
PCR 的要素
基本的PCR 须具备1.要被复制的DNA 模板 (Template) 2.界定复制范围两端的引物(Primers). 3.DNA 聚合酶 (Taq. Polymearse) 4.合成的原料及水。PCR 的反应包括三个主要步骤,分别是1). Denaturation 2). Annealing of primers, and 3). Extension of primers。 所谓 Denaturing乃是将DNA 加热变性, 将双股的DNA 加热后转为单股DNA 以做为复制的模板. 而Annealing 则是令 Primers于一定的温度下附着于模板DNA 两端。 最后在DNA 聚合酶 (e.g. Taq-polymerase) 的作用下进行引物的延长 (Extension of primers)及另一股的合成。
PCR 的历史
PCR 的发展可以说是从DNA 合成酵素的发现缘起。DNA 合成酵素最早于1955年发现 (DNA polymerase I), 而较具有实验价值及可得性的Klenow fragment of E. Coli 则是于70年代的初期由Dr. H. Klenow 所发现, 但由于这个酵素是一种易被热所破坏之酵素, 因此不符合一连串的高温连锁反应所需。现今所使用的酵素 (简称 Taq polymerase), 则是于1976年从热泉 Hot spring中的细菌(Thermus Aquaticus) 分离出来的。 它的特性就在于能耐高温,是一个很理想的酵素,但它被广泛运用则于80年代之后。PCR 的原始雏形概念是类似基因修复复制 (DNA repair replication),它是于1971年由 Dr. Kjell Kleppe 提出。他发表第一个单纯且短暂性基因复制 (类似PCR 前两个周期反应) 的实验。 而现今所发展出来的PCR 则于1983由 Dr. Kary B. Mullis发展出的,Dr. Mullis当年服务于一家物科技研究公司 (Perkin-Elmer Cetus Corporation). 目前这家公司在PCR 的相关仪器及原料上占有很大的�场。Dr.Mullis 并于1985年与 Saiki 等人正式表了第一篇相关的论文。此后,PCR 的运用一日千里,相关的论文发表质量可以说是令众多其它研究方法难望其项背。在 1989 年,Science 将PCR 中的DNA 合成酵素命名为当年的风云分子 (Molecule of the year),而PCR 本身则列为年度的重要科学发明产物。当然,它的原发明者更在往后获得诺贝尔的桂冠。
影响PCR 的因素
PCR 是非常直接、简单又具有强大威力的技术。诚如一位当年参与PCR 诞生的资深研究员Henry Erlich所言”在分子生物学的领域中,只要拥有它,你便可以无照营业”(PCR allows people to practice molecular biology without a liscence)。也因此,活用及慎用
PCR 是确保一定品质的必要条件。 PCR 本身虽然是一个单纯的实验技术,但是一个好的 PCR 反应及其产物则是受到很多因素的影响。这些因素色括反应中各种原料的浓度 (Taq. Polymerase, primers, dNTPs, MgCl2…),也包括整个反应中各步骤的温度与时间的设定。当然 DNA 模板(Template) 与 引信 (Primers) 本身条件也占有一定的重要性。近来的观念中,共溶剂诸如 Dimethyl sulfoxide (DSMO)、glycerol、Foramide and Tetramethylammonium chloride (TMAC) 也对整个反应产生若干重要的影响。
PCR 的运用
PCR 除了是一个诊断工具外,更重要的是它有广泛的运用。 PCR 本身可直接用来鉴定特定基因的存在与否,也可以用来侦测基因是否有异常 (Gene mutation, deletion, and rearrangement…)。例如,在医学上对遗传疾病或肿瘤癌症的诊断及预后的评估; 对细菌、病毒及霉菌感染的诊断。它也可成为一个生产线进而大量复制特定的基因进行基因密码的读取 ( DNA sequencing) 及其它的运用。举凡对生物标本及法医学上的样本鉴定,从单一毛发、一只精虫或一滴血液、唾液来找出凶手。 也可以做 DNA 指纹 (Fingerprints) 比对帮助亲子关系的鉴定。 PCR 更可以用于器官移植组织兼容性HLA的分析。另外在演化上的分析,经由 PCR 的运用也产生重大的进展。近来,在生物医学的研究上,特别是细胞间讯息的传递分子,诸如介白质 (Interleukines) 及各种生长因子 (Growth factors) 基因的表现都可用 PCR 来进行质与量的分析。
PCR 污染与对策
PCR 检测微量感染因子时,一定要注意产物残留污染的问题。
一. 污染的预防
进行PCR 操作时,操作人员应该严格遵守一些操作规程,最大程度地降低可能出现的PCR 污染或杜绝污染的出现。
(一)划分操作区:目前,普通PCR 尚不能做到单人单管,实现完全闭管操作,但无论是否能够达到单人单管,均要求实验操作在三个不同的区域内进行,PCR 的前处理和后处理要在不同的隔离区内进行:
1. 标本处理区,包括扩增摸板的制备;
2. PCR 扩增区,包括反应液的配制和PCR 扩增;
3. 产物分析区,凝胶电泳分析,产物拍照及重组克隆的制备。
各工作区要有一定的隔离,操作器材专用,要有一定的方向性。如:标本制备→PCR 扩增→产物分析→产物处理。
切记:产物分析区的产物及器材不要拿到其他两个工作区。
(二)分装试剂:PCR 扩增所需要的试剂均应在装有紫外灯的超净工作台或负压工作台配制和分装。所有的加样器和吸头需固定放于其中,不能用来吸取扩增后的DNA 和其他来源的DNA :
1. PCR 用水应为高压的双蒸水;
2. 引物和dNTP用高压的双蒸水在无PCR 扩增产物区配制;
3. 引物和dNTP应分装储存,分装时应标明时间,以备发生污染时查找原因。
(三) 实验操作注意事项 尽管扩增序列的残留污染大部分是假阳性反应的原因,样品间的交叉污染也是原因之一。因此,不仅要在进行扩增反应是谨慎认真,在样品的收集、抽提和扩增的所有环节都应该注意:
1. 戴一次性手套,若不小心溅上反应液,立即更换手套;
2. 使用一次性吸头,严禁与PCR 产物分析室的吸头混用,吸头不要长时间暴露于空气中,避免气溶胶的污染;
3. 避免反应液飞溅,打开反应管时为避免此种情况,开盖前稍离心收集液体于管底。若不小心溅到手套或桌面上,应立刻更换手套并用稀酸擦拭桌面;
4. 操作多份样品时,制备反应混合液,先将dNTP、缓冲液、引物和酶混合好,然后分装,这样即可以减少操作,避免污染,又可以增加反应的精确度;
5. 最后加入反应模板,加入后盖紧反应管;
6. 操作时设立阴阳性对照和空白对照,即可验证PCR 反应的可靠性,又可以协助判断扩增系统的可信性;
7. 尽可能用可替换或可高压处理的加样器,由于加样器最容易受产物气溶胶或标本DNA 的污染,最好使用可替换或高压处理的加样器。如没有这种特殊的加样器,至少PCR 操作过程中加样器应该专用,不能交叉使用,尤其是PCR 产物分析所用加样器不能拿到其它两个区;
8. 重复实验,验证结果,慎下结论。
二. 追踪污染源
如果不慎发生污染情况,应从下面几条出发,逐一分析,排除污染。
(一)设立阴阳性对照:有利于监测反应体系各成分的污染情况。选择阳性对照时,应选择扩增弱,且重复性好的样品,因强阳性对照可产生大量不必要的扩增序列,反而可能成为潜在的污染源。如果以含靶序列的重组质粒为对照,100个拷贝之内的靶序列就足以产生阳性扩增。阴性对照的选择亦要慎重,因为PCR 敏感性极高,可以从其它方法(Sourthern 印迹或点杂交等)检测阴性的标本中检测出极微量的靶分子。此外,每次扩增均应包括PCR 体系中各试剂的时机对照,即包括PCR 反应所需的全部成分,而不加模板DNA ,这对监测试剂中PCR 产物残留污染是非常有益的。如果扩增结果中试剂对照为阳性结果,就是某一种或数种试剂被污染了。此时,要全部更换一批新的试剂进行扩增,扩增时设立不同的反应管,每一管含有一种被检测试剂,在检出污染试剂后,应马上处理。
(二)环境污染:在排除试剂污染的可能性外,更换试剂后,若不久又发现试剂被污染了,如果预防措施比较严密,则考虑可能为环境污染。
环境污染中常见的污染源主要有:
1. 模板提取时真空抽干装置;
2. 凝胶电泳 加样器;
3. 电泳 装置;
4. 紫外分析仪;
5. 切胶用刀或手术刀片;
6. 离心机;
7. 冰箱门把手,冷冻架,门把手或实验台面等;
此时可用擦拭实验来查找可疑污染源。1)用无菌水浸泡过的灭菌棉签擦拭可疑污染源;2)0.1ml去离子水浸泡;3)取5ml做PCR 实验;4)电泳 检测结果。
8. 气溶胶。如果经过上述追踪实验,仍不能查找到确切污染源,则污染可能是由空气中PCR 产物的气溶胶造成的,此时就应该更换实验场所,若条件不允许,则重新设计新的引物(与原引物无相关性)。
三.污染处理
(一)环境污染
1. 稀酸处理法:对可疑器具用1mol/L盐酸擦拭或浸泡,使残余DNA 脱嘌呤;
2. 紫外照射(UV)法:紫外波长(nm)一般选择254/300nm,照射30min即可。需要注意的是,选择UV作为消除残留PCR 产物污染时,要考虑PCR 产物的长度与产物序列中碱基的分布,UV照射仅对500bp以上长片段有效,对短片段效果不大。UV照射时,PCR 产物中嘧啶碱基会形成二聚体,这些二聚体可使延伸终止,但并不是DNA 链中所有嘧啶均能形成二聚体,且UV照射还可使二聚体断裂。形成二聚体的程度取决于UV波长,嘧啶二聚体的类型及与二聚体位点相邻核苷酸的序列。在受照射的长DNA 链上,形成二聚体缺陷的数量少于0.065/碱基,其他非二聚体的光照损耍ㄈ缁范⊥樾袜奏じ春咸澹�叵汆奏ひ叶�迹?a href="/DNA/index.html">DNA 链间与链内的交联和DNA 断裂等)均可终止Taq DNA 聚合酶的延伸。这些位点的数量与二聚体位点相当。如果这些位点(0.13/碱基)在DNA 分子上随机分布,一个500bp片段的DNA 分子链上将有32处损伤位点,那么,105个这样的分子中每个分子中会至少有一处损伤。相反,如果100bp的片段,每条链上仅有6处损伤,105个拷贝分子中将有许多分子没有任何损伤。这就是UV照射有一定的片段长度限制的原因。
(二)反应液污染
可采用下列方法之一处理:
1. DNase I法:PCR 混合液(未加模板和Taq聚合酶)加入0.5U DNase I,室温反应30 min后加热灭活,然后加入模板和Taq聚合酶进行正常PCR 扩增。该方法的优点是不需要知道污染DNA 的序列;
2. 内切酶法:选择识别4个碱基的内切酶(如Msp I和Taq I等),可同时选择几种,以克服用一种酶只能识别特定序列的缺陷,室温作用1h 后加热灭活进行PCR ;
3. 紫外照射法:未加模板和Taq聚合酶的PCR 混合液进行紫外照射,注意事项与方法同上述UV照射法;
4. g射线辐射法:1.5kGy的辐射可完全破坏0.1ng基因组 DNA ,2.0 kGy可破坏104拷贝的质粒分子,4.0 kGy仍不影响PCR ,但高于此限度会使PCR 扩增效率下降。引物可受照射而不影响PCR ,g射线是通过水的离子化产生自由基来破坏DNA 的。
(三)尿嘧啶糖苷酶(UNG)法
由于UV照射的去污染作用对500bp以下的片段效果不好,而临床用于检测的PCR 扩增片段通常为300bp左右,因此UNG的预防作用日益受到重视和肯定。
1. 原理:在PCR 产物或引物中用dU 代替dT。这种dU化的PCR 产物与UNG一起孵育,因UDG可裂解尿嘧啶碱基和糖磷酸骨架间的N-糖基键,可除去dU而阻止TaqDNA 聚合酶的延伸,从而失去被再扩增的能力。UNG对不含dU的模板无任何影响。UNG可从单或双链DNA 中消除尿嘧啶,而对RNA中的尿嘧啶和单一尿嘧啶分子则无任何作用。
2. dUTP法:用dUTP代替dTTP,使产物中掺入大量dU。在再次进行PCR 扩增前,用UNG处理PCR 混合液即可消除PCR 产物的残留污染。由于UNG在PCR 循环中的变性一步便可被灭活,因此不会影响含dU的新的PCR 产物。
3. dU引物法:合成引物时以dU 代dT,这样PCR 产物中仅5�端带dU。UNG处理后,引物失去了结合位点而不能扩增。对长片段(1-2kb以上)的扩增用dUTP法效率较用dTTP低,而用dU法就可克服这一缺点。dU引物最好将dU设计在3�端或近�端。该法仅能用于引物以外试剂的处理。
4. 优点:可以去除任何来源的污染;UNG处理可以和PCR 扩增在同一个反应管内进行;由于扩增产物中有大量dU存在,可彻底消除污染源。
5. 需注意的是掺入dUTP的DNA 不应对产物的任何操作有影响,在进行PCR 产物克隆时,应该转化UNG-(UNG缺陷)大肠杆菌受体菌,否则转化产物会被受体菌UNG消化掉。
(四) 固相捕获法
用于去除标本中污染的核酸和杂质,原理如下:1)用一生物素标记的单链RNA探针与待扩核酸杂交,杂交区域是非扩增区;2)用包被链霉亲和素的固相载体来捕获带有生物素探针的杂交核酸,通过漂洗可去除污染的扩增产物和杂质;3)洗脱靶分子后用特异引物扩增非RNA探针杂交区域。第2)步的漂洗后可用PCR 检测以确定标本是否被扩增产物或重组质粒污染。
(五)RS-PCR 法(RNA-specific PCR )
也称为链特异性PCR ,主要指用于RNA模板的特异性PCR 法,该法可明显降低假阳性而不影响PCR 的敏感性。其关键在于设计引物,逆转录引物的3�端(A区)有2 0个核苷酸左右为模板的特异性互不序列,5�端2 0个核苷酸(C区)为附加修饰碱基。与mRNA逆转录后,经超速离心使 cDNA 与多余引物分开,再用和第二引物(C)以第一链cDNA 为模板合傻诙��DNA ,以后的PCR 循环中用逆转录引物的B区和引物C进行扩增加尾cDNA ,而污染的DNA 或质粒DNA 才不会被扩增。
(六)抗污染引物法
该对引物扩增时通过病毒DNA 克隆如入质粒的位点。这一区域只存在完整的原病毒中,在重组质粒中,这一区域分成两个区域与克隆位点被。如果重组质粒污染了标本,也不能扩增出任何条带,即使出现了扩增带,其大小也与预期的不同。只有原病毒DNA 才能被引物扩增,因此只要出现预期大小的扩增带就可以证明标本是阳性的,该法试用于环状靶分子系列。
四.其它PCR 检测方法:
(一) 两步法:是指在用套式PCR 方法扩增某些含量低微的标本时,两对引物在同一个管中以简化步骤,减少污染。通常第一步进行20-25个循环,扩增外引物片段;第二步再进行10个循环,扩增内引物片段。两步法对内外引物的Tm值有特殊要求,即内外引物的退火温度高(如68℃),在此温度下内引物不与模板退火,然后降低退火温度(至55℃)再扩增内引物片段,这样,在操作过程中,仅打开
PCR 反应管一次,大大减少了污染的可能性。
(二) 荧光法:亦称荧光PCR 技术(fluoresence PCR , F-PCR ),是1995年由美国PE公司首先研制成功的,它融汇了PCR 的灵敏性、DNA 杂交的特异性和光谱技术精确定量的优点,电脑同步跟踪,数据自动化处理,直接探测PCR 过程中的变化以获得定量的结果,不需要做PCR 后处理或检测,完全闭管操作。探针标记除用TET和FAM外,还可用HEX、JOE作为报告荧光,3′端的淬灭基团常用TAMRA。在探针保持完整时,荧光报告基团的荧光被荧光抑制基团淬灭,而在探针被切断后,荧光报告基团才发出报告荧光,且荧光的强度与PCR 产物的数量呈正比。荧光检测仪器透过PCR 管壁能直接检测到荧光信号的波长和长度变化。
主要有以下优点:
1.探针特异性强,假阳性率低;
2.操作快速,不需要PCR 后处理;
3.定量范围宽,HBV 0.4fg-4000fg/ml(102-106 Dane′s particle/ml);
4.闭管操作,PCR 产物污染少;
5.灵敏度高。
主要方法有:
1..荧光探针法:进行荧光PCR 检测时,要求荧光探针必须完全与靶基因互补,长度以20-30个碱基为宜,必要时3′端磷酸化封闭,以防在扩增时作为引物延伸。该方法利用Taq酶的3′→5′聚合酶活性及5′→3′外切酶活性,可以在链延伸过程中实现链替换,并将被替换的探针切断,故可进行定性与定量检测。
荧光探针5′端标记的TAMRA,在480nm激发下产生530nm的红色荧光;3′端标记的FAM,激发后产生绿色荧光。PE公司推出的TaqMan系统,即采用双荧光探针,如配合使用PCR 扩增与荧光检测合二为一的仪器,可进行实时(real-time)定量检测。
2.分子信标法:分子信标(molecular beacon)是一个发夹样结构的特异探针,其环状部分与靶序列互补。在室温时,分子信标的发夹紧闭,荧光淬灭。PCR 扩增时,随着温度升高,发夹松开,与单链模板特异结合,发出荧光。荧光强度与模板呈正比,故可用于PCR 产物的定性及定量。
总之,人类在迈入廿一世纪中即将出现若干的突破,生物医学便是其中重要的一项。在过去三、四十年耒,像PCR 这样影响深远的技术实在很难找到。它的震撼, 除了众多的得奖外(包括诺贝尔奖),更在于它的可塑性、修饰性及全方位的运用。未来的生物医学领域中,它也必定继续扮演举足轻重的角色。
参考资料
1. 1. Templeton NS. The polymerase chain reaction- History, Methods and Applications. Diagnostic Molecular Pathology .1992;1(1): 58-72
2. 2. Innis MA, Gelfand DA, Sninsky JJ . The use of cosolvents to enhance amplification by the polymerase chain reaction. In PCR strategies, Academic Press.1995: 3-16
3. 3. Chien A, Edgar DB,Trela JM. Deoxyribonucleic acid polymerase from the extreme thermophile Thermus aquaticus. J Bacteriol 1976;127:1550-7
4. 4. Saiki RK, et al. Enzymatic amplification of beta-globulin genomic sequences and restriction site analysis for the diagnosis of sickle cell anemia. Science 1985;230:1350-4
5. 5. Mullis KB, Faloona Fa. Specific synthesis of DNA in vitro via a polymerase-catalysed chain reaction. Methos Enzymol 1987;155:335-50
6. 6. Watson JD. et al. The polymearse chain reaction. In Recombinant DNA . Scientific american book. 1992;79-98.