培养胶质瘤干细胞
互联网
胶质瘤是颅内最常见的肿瘤,病因不清。切除后容易复发,放射治疗和化疗效果不理想。近年来从成年的脑组织中可以培养出神经干细胞,传统的观点认为,胶质瘤中只含有胶质细胞,没有神经元。
近期的研究证明,胶质瘤在体外分化为神经元和星形胶质细胞,证明了胶质瘤中存在干细胞的可能性。这种细胞能够同时表达神经元和星形胶质细胞的标志物,说明了此种细胞可能存在逆分化的现象,这反映了这种细胞的恶性行为。最近从大鼠C6胶质瘤中也获得干细胞样细胞,说明这种干细胞在胶质瘤的发病中可能是普遍存在的。
越来越多的事实支持胶质瘤起源于中枢神经内业已存在的内生性集落细胞,这种细胞可能就是神经干细胞,但尚未找到直接证据。
神经干细胞、正常胶质细胞和胶质瘤细胞三者之间是否可以转化,以及如何转化的机制,这方面的研究对胶质瘤发病机制的阐明和治疗都有明确的理论和实际意义。目前研究可从人类的胶质瘤组织中培养出类似神经干细胞的前体细胞,能够分化为神经元和星形胶质细胞。
采用培养材料有B27和N2添加剂、DMEM/F12培养基(Gibco/BRL);碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)、表皮生长因子(epidermal growth factor, EGF)和多聚赖氨酸均为Sigma公司产品;抗波形蛋白单克隆抗体(Dako ,1 :100)、抗神经微丝200(NF200)单克隆抗体(Dako,1:100);胎牛血清(FBS);抗巢蛋白(nestin)多克隆抗体(1:100,武汉博士德公司);抗S100单克隆抗体、抗胶质纤维酸性蛋白(GFAP)单克隆抗体、抗髓鞘基础蛋白单克隆抗体、抗半乳糖脑苷脂单克隆抗体和抗βⅢ型管蛋白单克隆抗体(1:500, Sigma);
在无菌条件下切取出肿瘤组织,切碎肿瘤组织,将切下的组织放入含有6g/L的葡萄糖的D-hanks液中。用吸管反复抽吸脑组织约20次,使细胞分散成细胞悬液,离心5min(1000 g),弃上清。N2培养基重悬细胞,细胞计数器下计数细胞,将细胞种植在培养板或培养瓶中。细胞密度为6×10 5 ~8 ×10 5 /cm 2 。
N2培养基配方如下:DMEM/F12(1:1),加入N2添加剂(1:100)、4.0 mmol/L谷氨酰胺、50kU/L的青霉素、50kU/L的链霉素、5mmol/L Hepes和5mg/L的肝素,最后用碳酸氢钠将pH值调至7.3~7.6。最后在培养基中加入20μg/L的bFGF和20μg/L的EGF,放在 37℃含有体积分数为5% CO 2 的培养箱内培养。
细胞生长较满时,不用胰蛋白酶消化,采用机械方法分离细胞,离心弃上清,再种植到培养板上传代培养。2~3d换一半培养液,加入 bFGF和EGF使其终浓度为20μg/L 。细胞也可以在B27(1:50)培养基培养,即用B27替代N2,其它成分相同,也能获得相同的增殖效果。细胞可以用常规方法液氮冻存、复苏,冻存培养基为N2加入100g/L的胎牛血清。
悬浮培养的细胞种植到经多聚赖氨酸处理的培养皿中,培养基为含有20g/L FBS的DMEM/F12/N2。
经一段时间的培养后进行免疫细胞化学检查。 0.01M PBS洗去培养液,4g/L的多聚甲醛固定 15min;PBS洗3次,每次5min; 2.5g/L Triton X-100处理15min;PBS洗3次,每次5min;含有1g/L马血清的一抗37℃处理1.5h,4℃过夜;PBS洗 3次,每次5min;以后步骤按试剂盒说明书进行,染色直接在显微镜下观察、记数、照相。记数每种神经细胞标志物阳性细胞的比例(显微镜下计数200个细胞中阳性细胞数,分别随机计数5次,实验重复3次)。
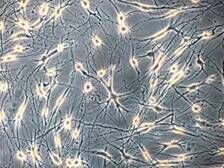
原代培养分离的细胞形态大小不一,培养皿内培养48h,可见细胞开始聚集成球,形成类似神经干细胞的神经球(neurosphere),细胞可以成悬浮状态、半悬浮状态或贴壁生长,随着培养时间的延长可见神经球增大,贴壁细胞长出突起。神经球周边细胞较亮,中心区细胞密度高,透光度差。
细胞的生长速度与种植密度密切相关,细胞密度较高时分裂速度快,密度较低时(1000~10000/cm 2 ),细胞分裂速度明显减慢。神经球较大时生长受限制,必需及时传代,将神经球分离成单细胞,再加入培养基进行传代培养,但在此过程中有大量的细胞死亡,可能由于传代过程中对细胞的机械损伤所致,培养的细胞在体外至少可维持2个月,增殖约10~15倍。
胶质瘤干细胞的分化:神经球吸管吹打分散后种植在多聚赖氨酸处理的培养皿上,因神经球细胞结合紧密,大部分细胞仍呈球形状态,少数细胞分散为单细胞。贴壁后早期为圆形细胞,发出的突起多为2个,少有3个以上突起;贴壁时间较长时(如20d),孤立的细胞开始分化为终末细胞,呈现为典型的神经元或胶质细胞的形态。种植2d后进行免疫细胞化学检查,接近100%的细胞表达巢蛋白和波形蛋白,表明它们的神经干细胞属性。
巢蛋白的阳性部位是胞质中,早期伸出的突起也呈阳性表达,细胞核无表达。波形蛋白的表达部位与波形蛋白类似。分离的细胞贴壁后加入含20g/L FBS的DMEM/F12/N2培养基,不加bFGF和EGF,继续培养10d,细胞固定后行免疫细胞化学检查。部分细胞分化为典型的神经元形态,表达β Ⅲ型管蛋白。NF200阳性细胞的形态也多样,可以是神经元的形态,也有胶质细胞样细胞表达NF200。分化的大部分细胞为GFAP阳性细胞,细胞呈多角、不规则形或成纤维细胞形态,这类细胞S100也阳性表达,GFAP阳性细胞也有些具有典型的神经元的形态。
为什么肿瘤是异质性的,从细胞表型和增殖潜能的角度来说,一些肿瘤可能起源于一小群肿瘤干细胞,由它们产生不同表型的增殖潜能不强的肿瘤细胞。这些肿瘤干细胞可能由于正常的干细胞自我更新失调发生突变所致。.在人类的白血病,肿瘤克隆的组织是有层次性的,起源于数量极少的白血病干细胞,这种细胞拥有广泛的增殖和自我更新能力,它们对维持肿瘤的克隆是必需的。
近来的研究证明,不仅在胚胎期的脑组织中存在神经干细胞,在很多的成年的哺乳动物脑室下区,齿状回能持续产生神经元[4],神经干细胞在成人脑中分离培养成功,向胶质瘤起源细胞的传统学说发出了挑战。神经节胶质细胞瘤、少突胶质细胞瘤和星形胶质细胞瘤等可能来自相应的前体细胞;神经干细胞移植后的潜在致瘤性、神经干细胞转基因后变为胶质瘤,这些实验结果支持胶质瘤起源于中枢神经内的具有增殖和分化潜能的干细胞或前体细胞,但尚未找到确凿的直接证据。
大鼠胚胎脑组织来源的神经干细胞能够表达其它胚层(如垂体)相关的转录因子和标志物,这说明在合适的刺激条件下,神经干细胞不仅能够分化为神经细胞,也可以分化为大脑内不存在的其它细胞,它们具有一定的多能性。这提示神经干细胞异常突变导致胶质瘤发生的可能。