PCR引物设计及评价
互联网
【实验目的】
1、掌握引物设计的基本要求,并熟悉使用Primer premier5.0软件进行引物搜索。
2、掌握使用软件oligo6.0对设计的引物进行评价分析。
【实验原理】
一、引物设计原则
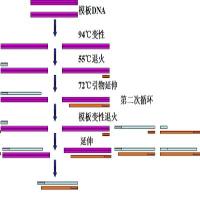
聚合梅链式反应(polymerase chain reaction)即PCR技术,是一种在体外快速扩增特定基因或DNA 序列的方法,故又称基因的体外扩增法。PCR技术已成为分子生物学研究中使用最多,最广泛的手段之一,而引物设计是PCR技术中至关重要的一环,使用不合适的PCR引物容易导致实验失败:表现为扩增出目的带之外的多条带(如形成引物二聚体带),不出带或出带很弱,等等。现在PCR引物设计大都通过计算机软件进行,可以直接提交模板序列到特定网页,得到设计好的引物,也可以在本地计算机上运行引物设计专业软件。引物设计原则如下:
1、引物应在序列的保守区域设计并具有特异性。引物序列应位于基因组DNA的高度保守区,且与非扩增区无同源序列。这样可以减少引物与基因组的非特异结合,提高反应的特异性;
2、引物的长度一般为15-30 bp。常用的是18-27 bp,但不应大于38,因为过长会导致其延伸温度大于74℃,不适于Taq DNA聚合酶进行反应;
3、引物不应形成二级结构。引物二聚体及发夹结构的能值过高(超过4.5kcal/mol)易导致产生引物二聚体带,并且降低引物有效浓度而使PCR反应不能正常进行;
4、引物序列的GC含量一般为40-60%。过高或过低都不利于引发反应。上下游引物的GC含量不能相差太大;
5、引物所对应模板位置序列的Tm值在72℃左右可使复性条件最佳。Tm值的计算有多种方法,如按公式Tm=4(G+C)+2(A+T);
6、引物5'端序列对PCR影响不太大,因此常用来引进修饰位点或标记物。可根据下一步实验中要插入PCR产物的载体的相应序列而确定。
7、引物3'端不可修饰。引物3'端的末位碱基对Taq酶的DNA合成效率有较大的影响。不同的末位碱基在错配位置导致不同的扩增效率,末位碱基为A的错配效率明显高于其他3个碱基,因此应当避免在引物的3'端使用碱基A。
8、引物序列自身或者引物之间不能在出现3个以上的连续碱基,如GGG或CCC,也会使错误引发机率增加;
9、G值是指DNA双链形成所需的自由能,该值反映了双链结构内部碱基对的相对稳定性。应当选用3'端 G值较低(绝对值不超过9),而5'端和中间 G值相对较高的引物。引物的3'端的 G值过高,容易在错配位点形成双链结构并引发DNA聚合反应;
值得一提的是,各种模板的引物设计难度不一。有的模板本身条件比较困难,例如GC含量偏高或偏低,导致找不到各种指标都十分合适的引物;在用作克隆目的的PCR因为产物序列相对固定,引物设计的选择自由度较低,在这种情况只能退而求其次,尽量去满足条件。
二、引物设计软件Primer premier5.0及oligo6.0
"Premier"的主要功能分四大块,其中有三种功能比较常用,即引物设计、限制性内切酶位点分析和DNA 基元(motif)查找。"Premier"还具有同源性分析功能,但并非其特长,在此略过。此外,该软件还有一些特殊功能,其中最重要的是设计简并引物,另外还有序列"朗读"、DNA 与蛋白序列的互换、语音提示键盘输入等等。有时需要根据一段氨基酸序列反推到DNA 来设计引物,由于大多数氨基酸(20 种常见结构氨基酸中的18 种)的遗传密码不只一种,因此,由氨基酸序列反推DNA 序列时,会遇到部分碱基的不确定性。这样设计并合成的引物实际上是多个序列的混和物,它们的序列组成大部分相同,但在某些位点有所变化,称之为简并引物。
遗传密码规则因物种或细胞亚结构的不同而异,比如在线粒体内的遗传密码与细胞核是不一样的。"Premier"可以针对模板DNA 的来源以相应的遗传密码规则转换DNA 和氨基酸序列。软件共给出八种生物亚结构的不同遗传密码规则供用户选择,有纤毛虫大核(Ciliate Macronuclear)、无脊椎动物线粒体(Invertebrate Mitochondrion)、支原体(Mycoplasma)、植物线粒体(Plant Mitochondrion)、原生动物线粒体(Protozoan Mitochondrion)、一般标准(Standard)、脊椎动物线粒体(Vertebrate Mito-chondrion)和酵母线粒体(Yeast Mitochondrion)。
对引物进行分析评价的的软件中,"oligo" 是最著名的。它的使用并不十分复杂,Oligo 6.0的界面是三个图,Tm图、ΔG图和Frq图。"Oligo"的功能比"Premier"还要单一,就是引物设计。但它的引物分析功能如此强大以至于能风靡全世界。所以引物设计的最佳搭配是"Premier"进行引物搜索"Oligo" 对引物分析评价。
【实验内容】
1、使用Primer premier5.0软件进行人瘦素 (leptin) mRNA引物的设计。
2、使用oligo6.0对引物进行评价分析。
【实验方法】
一、引物搜索
1、打开Primer premier5.0软件,调入人瘦素 (leptin) 基因序列:点击"file" "open" "DNA sequence";或者直接点击"file" "new" "DNA sequence",弹出一对话框,然后将序列人瘦素 (leptin) 基因复制在空白框。
2、点击"Primer";
3、进一步点击"search" 按钮,出现"search criteria"窗口,有多种参数可以调整。搜索目的(Seach For)有三种选项,PCR引物(PCR Primers),测序引物(Sequencing Primers),杂交探针(Hybridization Probes)。搜索类型(Search Type)可选择分别或同时查找上、下游引物(Sense/Anti-sense Primer,或Both),或者成对查找(Pairs),或者分别以适合上、下游引物为主(Compatible with Sense/Anti-sense Primer)。另外还可改变选择区域(Search Ranges),引物长度(Primer Length),选择方式(Search Mode),参数选择(Search Parameters)等等。使用者可根据自己的需要设定各项参数。我们将Product Size设置300-350,其他参数使用默
认值。
然后点击"OK" ,随之出现的Search Progress窗口中显示Search Completed时,再点击"OK"。
4、这时搜索结果以表格的形式出现,有三种显示方式,上游引物(Sense),下游引物(Anti-sense),成对显示(Pairs)。默认显示为成对方式,并按优劣次序(Rating)排列,满分为100,即各指标基本都能达标。
5、按照搜寻结果显示,在主窗口中检查该引物对的二级结构情况,逐条分析,依次筛选。下面进行序列筛选:点击其中一对引物,如第21#引物,在"Peimer Premier"主窗口,如图所示:该图分三部分,最上面是图示PCR模板及产物位置,中间是所选的上下游引物的一些性质,最下面是四种重要指标的分析,包括发夹结构(Hairpin),二聚体(Dimer),错误引发情况(False Priming),及上下游引物之间二聚体形成情况(Cross Dimer)。当所分析的引物有这四种结构的形成可能时,按钮由"None" 变成"Found" ,点击该按钮,在左下角的窗口中就会出现该结构的形成情况。一对理想的引物应当不存在任何一种上述结构,因此最好的情况是最下面的分析栏没有"Found",只有"None" 。值得注意的是中间一栏的末尾给出该引物的最佳退火温度,可参考应用。
二、引物分析
1、打开oligo的页面如下:
2、单击file菜单再点open或点击"打开"快捷图标或者用快捷键"CTrl+O"可弹出一对话框,然后选择序列人瘦素 (leptin) 基因。出现以下窗口。
3、点击"window"再点击"Tile",出现以下窗口,图中显示的三个指标分别为Tm、ΔG和Frq,因为分析要涉及多个指标,起动窗口的cascade排列方式不太方便,可从windows菜单改为tile方式。如果觉得太拥挤,可去掉一个指标。
?G值反映了序列与模板的结合强度,最好引物的?G值在5'端和中间值比较高,而在3'端相对低
Tm值曲线以选取72℃附近为佳,5'到3'的下降形状也有利于引物引发聚合反应。
Frq曲线为"Oligo 6"新引进的一个指标,揭示了序列片段存在的重复机率大小。选取引物时,宜选用3'端Frq值相对较低的片段。
4、在设计时,可依据图上三种指标的信息选取序列,如果觉得合适,可点击Tm图块上左下角的Upper按钮 ,选好上游引物,此时该按钮变成红色,表示上游引物已选取好。下游引物的选取步骤基本同上,只是按钮变成Lower。
5、当上下游引物全选好以后,需要对引物进行评价。可以用"Analyse"菜单分析你的引物:比如有无引物二聚体、发卡结构等等。首先检查引物二聚体尤其是3'端二聚体形成的可能性。需要注意的是,引物二聚体有可能是上游或下游引物自身形成,也有可能是在上下游引物之间形成(cross dimer)。二聚体形成的能值越高,越不符合要求。一般的检测(非克隆)性PCR,对引物位置、产物大小要求较低,因而应尽可能选取不形成二聚体或其能值较低的引物。
第二项检查是发夹结构(hairpin);与二聚体相同,发夹结构的能值越低越好。一般来说,这两项结构的能值以不超过4.5为好。当然,在设计克隆目的的PCR引物时,引物两端一般都添加酶切位点,必然存在发夹结构,而且能值不会太低。这种PCR需要通过灵活调控退火温度以达到最好效果,对引物的发夹结构的检测就不应要求太高。第三项检查为GC含量,以45-55%为宜。有一些模板本身的GC含量偏低或偏高,导致引物的GC含量不能被控制在上述范围内,这时应尽量使上下游引物的GC含量以及Tm值保持接近,以有利于退火温度的选择。
当我们结束以上三项检测,按Alt+P键弹出PCR窗口,其中总结性地显示该引物的位置、产物大小、Tm值等参数,最有用的是还给出了推荐的最佳退火温度和简单的评价。