测定细胞免疫功能首先要从人或动物外周血或组织中获取有活性的细胞,如淋巴细胞、巨噬细胞、粒细胞等。取得有活性的细胞应根据不同目的,采用不同方法,考虑:
(1)细胞纯度;
(2)细胞获得量;
(3)细胞活力;
(4)使用方法的简易程度和本室条件等。
目前常用Ficoll密度梯度离心法直接分离和纯化外周血单个核细胞。
(一) 原理:
常用来分离人外周血单个核细胞(PBMC)的分层液比重是 1.077±0.001 的 聚 蔗糖(Ficoll)-泛影葡胺(Urografin)(F/H)分层液。Ficoll是蔗糖的多聚体,呈中性,犌W水性高,平均分子量为400,000,当密度为1.2g/ml仍未超出正常生理性渗透压,也不穿过生物膜。红细胞、粒细胞比重大,离心后沉于管底;淋巴细胞和单核细胞的比重小于或等于分层液比重,离心后漂浮于分层液的液面上,也可有少部分细胞悬浮在分层液中。吸取分层液液面的细胞,就可从外周血中分离到单个核细胞。
(二) 方法:
1. 在短中管中加入适量淋巴细胞分离液。
2. 取肝素抗凝静脉血与等量Hank's液或RPMI1640充分混匀,用滴管沿管壁缓慢叠加于分层液面上,注意保持清楚的界面。水平离心2000rpm×20分钟。
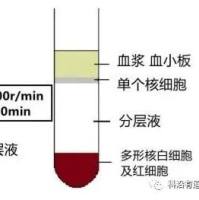
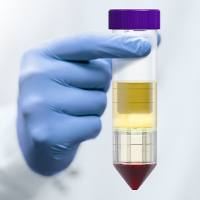
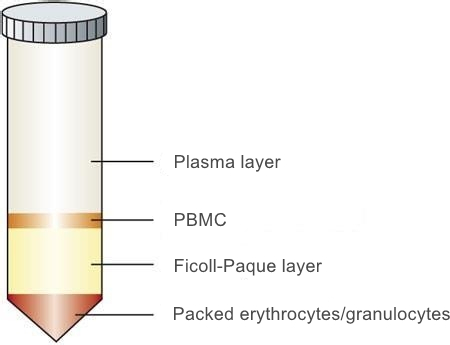
3. 离心后管内分为三层,上层为血浆和Hank's液,下层主要为红细胞和粒细胞。中层为淋巴细胞分离液,在上、中层界面处有一以单个核细胞为主的白色云雾层狭窄带(如下图),单个核细胞包括淋巴细胞和单核细胞。此外,还含有血小板。
4. 用毛细血管插到云雾层,吸取单个核细胞。置入另一短中管中,加入5倍以上体积的Hank's液或RPMI1640,1500rpm×10分钟,洗涤细胞两次。
5. 末次离心后,弃上清,加入含有10%小牛血清的RPMI1640,重悬细胞。取一滴细胞悬液与一滴0.2%台盼兰染液混合,于血球计数板上,计数四个大方格内的细胞总数。
单个核细胞浓度(细胞数/1毫升细胞悬液)=
4个大方格内细胞总数
────────── × 104×2(稀释倍数)
4
6. 细胞活力检测:死的细胞可被染成兰色,活细胞不着色。计数200个淋巴细胞。计算出活细胞百分率。
活细胞数
活细胞百分率=────── ×100%
总细胞数
用本法分离PBMC,纯度在90%以上,收获率可达80~90%,活细胞百分率在95%以上。
(三) 试剂和材料:
比重1.077±0.001的聚蔗糖-泛影葡胺(商品名为淋巴细胞分离液)。
Hank's液(无Ca2+、Mg2+)
10%小牛血清RPMI1640
0.2%台酚兰染色液,用生理盐水或等渗的PBS配制。
肝素用Hank's液或生理盐水稀释成500单位/ml,牽9凝人外周血肝素用量约为50单位/1毫升血。
短中管、毛细滴管、1毫升和10毫升刻度吸管。
无菌干燥注射器针头。
碘酒,75%酒精,无菌棉球,镊子,橡皮止血带。
血球计数板、显微镜、水平式离心机。
(四) 注意事项:
1. 抽取人外周静脉血时要注意无菌操作。
2. 操作全程应尽可能短时间内完成,以免增加死细胞数。
3. 用淋巴细胞分离液分离PBMC时,离心机转速的增加和减少要均匀、平稳,使保持清晰的界面。
4. 小鼠、兔等动物淋巴细胞比重与人不同,犛&配制相应密度的Percoll或不同比例的聚蔗糖和泛影葡胺。
(五) 附录
1. Hank's液(无Ca2+、Mg2+)配制法
NaCl 8.0克
KCl 0.4克
Na2HPO4·12H2O 0.12克
KH2HPO4 0.06克
葡萄糖 1.0克
双蒸水 1000毫克
1%酚红液 2毫克
将上列成分混合后溶化,分装于500毫升盐水瓶内,8磅15分钟灭菌,4℃冰箱保存,临用时调PH至7.3~7.6。
2. 细胞分层液配制法
9%聚蔗糖 24份
34%泛影葡胺 10%
混合,测比重为1.077~1.078,G5玻璃滤器过滤除菌。4℃冰箱保存备用。
3. 磷酸缓冲液(P
原液:
A液: 0.2M NaH2PO4溶液
NaH2PO4 27.6克
或NaH2PO4·2H2O 31.2克
蒸馏水 溶解至 1000毫升
B液:0.2M Ha2HPO4溶液
Ha2HPO4·12H2O 71.6克
蒸馏水溶解至1000毫升
各种不同PH值PB的配法
───────────────────────────────────────
PH 7.0 7.2 7.4 7.6 7.8 8.0
───────────────────────────────────────
A液(ml) 39.0 28.0 19.0 13.0 8.5 5.5
B液(ml) 61.0 72.0 81.0 87.0 91.0 94.5
───────────────────────────────────────
举例: 0.1M PH7.2PB
A液 28毫升
B液 72毫升
加蒸馏水 100ml
4. 血球保存液
葡萄糖 2.05克 枸椽酸钠 0.8克
氯化钠 0.42克 蒸馏水 100毫升
将上述成分混匀,略加温使其溶解,分装小瓶(100毫升)。经10磅、10分钟高压灭菌。4℃保存备用。
5. RPMI-1640培养液:
RPMT-1640(FLOW公司出品) 1袋
三蒸水 1000毫升
电磁搅拌30分钟:1N HCl调PH7.2~7.4(约加2.5毫升),过滤除菌,作无菌试验,4℃保存。
不完全RPMI-1640培养液:
RPMI-1640 95毫升
0.1M丙酮酸钠 1毫升
0.2M谷氨酰胺 1毫升
1M Hepes 1毫升
7.5% NaHCO3 1毫升
青霉素、链霉素(各1万单位) 1毫升
完全RPMI-1640培养液
不完全1640培养液 90毫升
灭活胎牛(或新生牛)血清 10毫升
Percoll不连续密度梯度沉淀法分离纯化淋巴细胞和淋巴母细胞
撰写 金伯泉
--------------------------------------------------------------------------------
(一) 原理
Percoll是一种包有乙烯吡咯烷酮的硅胶颗粒。渗透压很低(<20mosm/kg H2O), 粘度也很小,可形成高达1.3g/ml密度,采用预先形成的密度梯度时可在低离心力(200~1000g)于数分至数十分钟内达到满意的细胞分离结果。由于Percoll扩散常数低,所形成的梯度十分稳定。此外,Percoll不穿透生物膜,对细胞无毒害,因此广泛用于分离细胞、亚细胞成分、细菌及病毒,还可将受损细胞及其碎片与完好的活细胞分离。
(二)操作方法及注意事项
1.不同浓度(密度)Percoll溶液的制备: 先用9份Percoll与1份8.5% NaCl或1.5MPBS混合达到生理性渗透压,然后用生理溶液(0.85% NaCl或0.15M PBS)稀释到所需浓度。
Percoll浓度(%) 70 60 50 40 30 20
比重g/ml 1.090 1.077 1.067 1.056 1.043 1.031
2. 不连续密度梯度Percoll层的制备: 先将试管壁用牛血清湿润,除去多余血清,这种预处理可使逐层叠加的Percoll液平稳沿管壁流下,使形成满意的界面。在制备过程中一般用长针头注射器从高密度向低密度逐层放置,有时相邻两层Percoll比重相差不大时,可将Percoll液放入注射器中,小针头斜面紧贴管壁,任其自然慢慢流下。
3. 装样:样品体积和细胞浓度根据不同细胞而异,一般加样体积不宜过大,细胞浓度也不可过高,否则会影响细胞的分离和回收。
4. 离心:一般采用离心力为400g,时间20~25min。由于多层Percoll之间密度差别不大,因此离心机加速、降速时要慢,要平稳。
5. 取样:当所要分离的细胞绝大部分在两层的界面时,可逐层去除Percoll液后收集界面部位的细胞;有时大部分细胞位于Percoll层中,则需要逐层收集。收获含有Percoll液的细胞经2次洗涤后可供培养或检测用。
(三)分离纯化细胞举例
1. 富含NK活性大颗粒淋巴细胞(LGL)的纯化:按顺序由下向上逐层加50%、47.5%、45%、42.5%和40%五种不同密度的Percoll,如用10ml试管(或塑料管)分离,每层Percoll约1.2~1.5ml,初步从外周血中分离的PBMC细胞1×108悬于1ml培基中,按要求装样、离心和取样。一般富含NK杀伤活性的LGL细胞位于42.5%与45%Percoll界面以及上下二层的Percoll液中。
2. 纯化淋巴母细胞和除去死细胞:分别叠加50%和30%Percoll液。收取经PHA(或其它抗原、有丝分裂原)刺激PBMC,或含有较高比例异型的PBMC(如肾综合征出血热患者),按要求装样、离心和取样。位于管底的淋巴细胞为小淋巴细胞;两层Percoll之间为淋巴母细胞,纯度和回收率在80%以上,位于30%Percoll表面是死细胞。收获淋巴母细胞可进行表型、结构以及功能的研究。
(四) 人不同血细胞的漂浮密度
表 人不同血细胞的漂浮密度
──────────────┬──────────────────
细 胞 漂浮密度 │ 细 胞 漂浮密度
──────────────┼──────────────────
红细胞 1.09-1.11 │淋巴细胞 1.052-1.077
粒细胞 │ B淋巴细胞 1.062-1.075
嗜酸性 1.09-1.095 │ T淋巴细胞 1.065-1.077
嗜中性 1.080-1.085 │ 淋巴母细胞 1.065-1.077
单核细胞 1.050-1.066 │自然杀伤细胞 1.050-1.070
血小板 1.030-1.060 │
──────────────┴──────────────────
Percoll不连续密度梯度沉淀法分离纯化淋巴细胞和淋巴母细胞
撰写 金伯泉
--------------------------------------------------------------------------------
(一) 原理
Percoll是一种包有乙烯吡咯烷酮的硅胶颗粒。渗透压很低(<20mosm/kg H2O), 粘度也很小,可形成高达1.3g/ml密度,采用预先形成的密度梯度时可在低离心力(200~1000g)于数分至数十分钟内达到满意的细胞分离结果。由于Percoll扩散常数低,所形成的梯度十分稳定。此外,Percoll不穿透生物膜,对细胞无毒害,因此广泛用于分离细胞、亚细胞成分、细菌及病毒,还可将受损细胞及其碎片与完好的活细胞分离。
(二)操作方法及注意事项
1.不同浓度(密度)Percoll溶液的制备: 先用9份Percoll与1份8.5% NaCl或1.5MPBS混合达到生理性渗透压,然后用生理溶液(0.85% NaCl或0.15M PBS)稀释到所需浓度。
Percoll浓度(%) 70 60 50 40 30 20
比重g/ml 1.090 1.077 1.067 1.056 1.043 1.031
2. 不连续密度梯度Percoll层的制备: 先将试管壁用牛血清湿润,除去多余血清,这种预处理可使逐层叠加的Percoll液平稳沿管壁流下,使形成满意的界面。在制备过程中一般用长针头注射器从高密度向低密度逐层放置,有时相邻两层Percoll比重相差不大时,可将Percoll液放入注射器中,小针头斜面紧贴管壁,任其自然慢慢流下。
3. 装样:样品体积和细胞浓度根据不同细胞而异,一般加样体积不宜过大,细胞浓度也不可过高,否则会影响细胞的分离和回收。
4. 离心:一般采用离心力为400g,时间20~25min。由于多层Percoll之间密度差别不大,因此离心机加速、降速时要慢,要平稳。
5. 取样:当所要分离的细胞绝大部分在两层的界面时,可逐层去除Percoll液后收集界面部位的细胞;有时大部分细胞位于Percoll层中,则需要逐层收集。收获含有Percoll液的细胞经2次洗涤后可供培养或检测用。
(三)分离纯化细胞举例
1. 富含NK活性大颗粒淋巴细胞(LGL)的纯化:按顺序由下向上逐层加50%、47.5%、45%、42.5%和40%五种不同密度的Percoll,如用10ml试管(或塑料管)分离,每层Percoll约1.2~1.5ml,初步从外周血中分离的PBMC细胞1×108悬于1ml培基中,按要求装样、离心和取样。一般富含NK杀伤活性的LGL细胞位于42.5%与45%Percoll界面以及上下二层的Percoll液中。
2. 纯化淋巴母细胞和除去死细胞:分别叠加50%和30%Percoll液。收取经PHA(或其它抗原、有丝分裂原)刺激PBMC,或含有较高比例异型的PBMC(如肾综合征出血热患者),按要求装样、离心和取样。位于管底的淋巴细胞为小淋巴细胞;两层Percoll之间为淋巴母细胞,纯度和回收率在80%以上,位于30%Percoll表面是死细胞。收获淋巴母细胞可进行表型、结构以及功能的研究。
(四) 人不同血细胞的漂浮密度
表 人不同血细胞的漂浮密度
──────────────┬──────────────────
细 胞 漂浮密度 │ 细 胞 漂浮密度
──────────────┼──────────────────
红细胞 1.09-1.11 │淋巴细胞 1.052-1.077
粒细胞 │ B淋巴细胞 1.062-1.075
嗜酸性 1.09-1.095 │ T淋巴细胞 1.065-1.077
嗜中性 1.080-1.085 │ 淋巴母细胞 1.065-1.077
单核细胞 1.050-1.066 │自然杀伤细胞 1.050-1.070
血小板 1.030-1.060 │
──────────────┴──────────────────
(责任编辑:大汉昆仑王)