液体配制:
硼酸硼砂缓冲液:0.05M四硼化钠45ml,0.2M硼酸55ml,pH8.4;
胰酶-EDTA消化液:胰酶-0.125g;EDTA-0.2g;D-Hanks平衡盐液定容至100ml
所用的培养板、培养瓶或玻片预先经100μg/L多聚赖氨酸硼酸盐缓冲液于37℃包被4h,三蒸水洗三遍晾干备用。
操作步骤如下:
1、孕16d SD大鼠经戊巴比妥钠麻醉后,碘酒、75%乙醇消毒腹部皮肤,依次剪开皮肤、肌肉、皮下筋膜,无菌操作下取出胚胎放入预冷的D-Hanks平衡盐液中。
2、在解剖显微镜下分离并取出胚胎大脑皮层,除去脑膜,剪碎组织成约1mm3大小,加入胰酶-EDTA消化液并放入37℃孵箱内消化20min,中间摇晃一次。
3、随后用滴管吸出组织转移到装有预冷的培养液(DMEM+10%FBS)的离心管内终止消化液作用5min。
4、用滴管吸出组织转移到装有预冷的DMEM+10%FBS的离心管内,用火焰抛光的巴斯德滴管吹打数次,静置后取上清吸到另一支离心管内。重复上述步骤2~3次。
5、将所收集的上清经200目筛网过滤。
6、过滤后的细胞悬液于800r/min离心5min,弃上清,管内加入新鲜培养液(DMEM+20%FBS)并吹打成单细胞悬液。
7、细胞计数,调整细胞密度按1.5×105/cm2种入6孔板内,放入CO2孵箱中培养。培养48h后换液并加入Ara-C使其终浓度为1×10-5mM/L。Ara-C作用24h后全量换液。以后每隔3天半量换液一次。
【注意以下几点】
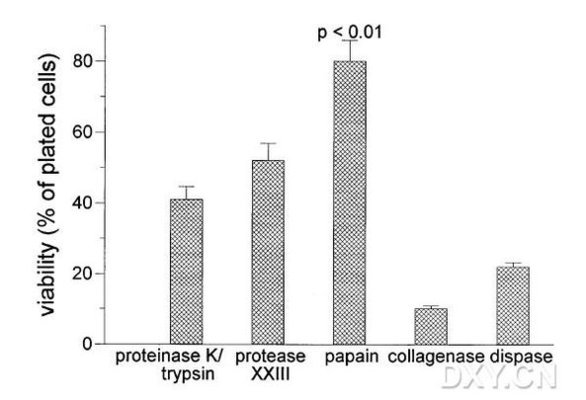
1、上面的步骤是传统方法。有许多地方可以进行改动:如消化时可以直接用0.125-0.25的胰酶消化15-20min左右,也可用DNA酶进行消化,有人还直接进行吹打,都可行。
2、上面虽然时大鼠皮层神经元,但是同样适用于小鼠,但是应该选择 孕13d 左右的小鼠。
3、神经元是一种比较难培养的细胞,因此在接种时细胞的密度一定要够!!
4、在玻片上培养神经元时,一定要注意玻片的来源和处理方法,这个非常重要,对神经细胞的影响是很大的。如果您现在在玻片上培养的神经元生长情况还不错的话,那么您在以后的培养中最好还是用同一来源(厂家)的玻片。
5、如果有B27和neurobasal培养基,那么就方便了(不用加AraC)--
(1)把细胞悬液用(DMEM+20%FBS)悬浮,种到培养皿上6-12h后,全量换成2%B27的neurobasal培养基,继续培养,3d半量换液。
(2)把细胞悬液用直接用2%B27的neurobasal培养基悬浮接种。
(3)可以用新生1d内的胎鼠皮层直接培养。