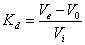蛋白质分子量测定——葡聚糖凝胶过滤法测定
互联网
|
目的要求 (1) 学习葡聚糖凝胶过滤法测定蛋白质的分子量的原理 (2) 掌握葡聚糖凝胶过滤法测定蛋白质的分子量的操作技术。 实验原理 葡聚糖凝胶(Sephadex)过滤法测定蛋白质分子量的原理,主要是依据这种凝胶具有分子筛作用,一定型号的凝胶具有大体上一定大小的孔径。在一定的凝胶柱内,凝胶孔隙所占的体积称为内水容积Vi,凝胶颗粒间的自由空间所占的体积称为外水容积V0。 当样品流经凝胶柱时,大于孔隙的大分子完全不滲入到凝胶内部,只需V0体积的洗脱液便可将其由一端洗脱到另一端;相反,如果样品体积小于孔隙,则需要V0+Vi体积的洗脱液,才能将它们由一端洗脱到另一端。中等分子(分子大小在上述两种极限之间)所需洗脱液体积介于两者之间,Ve=V0+KdVi(0<1)。< p=""> Kd为分配系数,它表示一种物质在孔隙内的滲透程度,相当于这种物质在孔隙内所占体积和孔隙总体积的比值。
如果假定蛋白质分子近于球形,同时没有显著的水合作用,则不同大小分子量的蛋白质,进入凝胶筛孔的程度不同,其洗脱体积决定于分子大小。 当蛋白质分子量在10000~15000时,蛋白质在葡聚糖凝胶柱上层析的洗脱体积和分子量的对数呈直线关系。若用已知分子量的标准蛋白质在一定型号葡聚糖凝胶柱上层析,精确测其洗脱体积,并以洗脱体积Ve对分子量的对数logMW作图,可获得一条标准曲线。未知分子量的蛋白质在相同条件下层析,根据其洗脱体积即可在标准曲线上求得分子量。 本方法测分子量设备简单,结果处理方便,因此应用较广泛。但本方法仅适用于轴比相近似为球状蛋白,对轴比大的纤维蛋白不适用;对含量大于5%的糖蛋白因有较大水合作用,测得分子量偏高;对含铁蛋白测定数据偏低。
由于Ve与柱的大小有关,如果用Ve/V0对logMW作图,同样可得一线性关系的标准曲线,且可消除柱的大小和吸附效应的误差。 1. 细胞色素c 2. 核糖核酸酶 3. 肌红蛋白 4. α-胰凝乳蛋白酶 5. 胰蛋白酶 6. 胃蛋白酶 7. 过氧化物酶 8. 卵清蛋白 9. 血清白蛋白 10. 铁蛋白
试剂和器材 一、试剂 洗脱液:0.05M Tris-HCl缓冲液(pH7.5),0.1M KCl溶液:称取12.12g Tris,15g KCl,先用少量去离子水溶解,再加入6.67mL浓HCl,用去离子水定容至2L。 蓝色葡聚糖2000;Sephsdex G-100;N-乙酰酪氨酸乙酯饱和溶液(以洗脱液饱和)。 二、材料 牛血清白蛋白(Mr 67 000);卵清蛋白(Mr 43 000);胰凝乳蛋白酶原(Mr 25 000);细胞色素c(Mr 12 800)。 三、仪器 层析柱;恒压洗脱瓶; 紫外检测仪或紫外分光光度计;自动分部收集器。 操作方法 一、溶胀凝胶 取Sephadex G-100 15g,加200mL蒸馏水,沸水浴中溶胀5小时。待溶胀平衡后,倾去上层清液,包括细颗粒,然后再放些蒸馏水搅乱,静置使凝胶下沉,再倾去上层清液,至无细颗粒为止。溶胀平衡和漂洗净的凝胶经减压抽气除去气泡,即可准备装柱。 二、装柱 层析柱必须粗细均匀,柱管大小可根据试剂需要选择。一般柱直径(内径)为1cm, 如果样品量比较多,最好用直径2 ~ 3cm的柱。通常柱愈长,分离效果愈好,但柱过长,实验时间长而且样品稀释度大,易扩散,反而分离效果不好。 当用作脱盐时,柱高度为50cm比较合适;在进行分级分离时,100cm高度就够了。 装柱时,将柱垂直至于铁架上。在柱中加约1/3柱容积的洗脱液,并赶净滤板下方气泡,使支持滤板底部完全充满液体,然后将柱的出口关闭。把已经溶胀好的凝胶调成薄浆,倾入柱内,胶粒逐渐扩散下沉。当沉积的胶床至2~3cm高时,打开柱的出口,并注意控制操作压以均匀不变的流速直到胶装完为止。 柱装好后,在床的上面盖上一张大小略小与柱内径的滤纸片,以防止样品中一些不溶物质混入床中和加样时凝胶被冲起。再以洗脱液平衡柱层,直至层析的胶床高不变为止。柱装得是否均匀,可用蓝色葡聚糖上柱检验;如果色带均匀下移,说明柱子已装好,可以使用。 三、上样 称取0.5mg蓝色葡聚糖2000(分子量200万以上)四份,分别放在称量瓶中,再称取标准蛋白牛血清白蛋白(Mr 67 000);卵清蛋白(Mr 43 000);胰凝乳蛋白酶原(Mr 25 000);细胞色素c(Mr 12 800)各10mg,分别放在各称量瓶中;各瓶加入N-乙酰酪氨酸乙酯饱和溶液0.5mL,使混合物溶解后分别上柱。 样品上柱是实验成败的关键之一,若样品稀释或上柱不均,会使区带扩散,影响层析效果。 上样时应尽量保持床面的稳定。先打开柱的出口,待柱中洗脱液流至距床表面1~2mm时,关闭出口,用滴管将样品慢慢地加至柱床表面,打开出口并开始计算流出体积,当样品滲入床中接近床表面1mm时关闭出口,同加样品时一样小心地加入少量洗脱液,再打开柱的出口,使床表面的样品也全部滲入柱内。这时样品已加好,在床的表面再小心地加洗脱液,使高出床表面3~5cm。 四、收集和鉴定 层析开始,在柱的出口处以试管分管收集流出液,流速为0.4mL/min, 4mL/管,收集液在280nm处测OD值。 最高的一个OD值时的体积即为吸收峰的洗脱体积Ve。当N-乙酰酪氨酸乙酯洗脱峰出现后(此峰洗脱体积不必记录);按同样的方法进行第二个标准蛋白质样品的上柱,操作方法和步骤同前。 将各标准蛋白质测得的洗脱体积Ve对它们的分子量对数作图,则应获得一线性的标准曲线。 注意事项 (1)根据层析柱的容积和所选用的凝胶溶胀后住床容积,计算所需凝胶干粉的重量,以将用作洗脱剂的溶液使其充分溶胀。 (2)层析柱粗细必须均匀,柱管大小可根据试剂需要选择。一般来说,细长的柱分离效果较好。若样品量多,最好选用内径较粗的柱,但此时分离效果稍差。柱管内径太小时,会发生“管壁效应”,即柱管中心部分的组份移动慢,而管壁周围的移动快。柱越长,分离效果越好,但柱过长,实验时间长,样品稀释度大,分离效果反而不好。 对于脱盐的柱一般都是短而粗,柱长(L)/直径(D)<10;对分级分离用的柱,L/D值可以比较大,对很难分离的组份可以达到L/D=100,一般选用内径为1cm,柱长100cm就够了。 (3)装柱要均匀,不要过松也不要过紧,最好也在要求的操作压下装柱,流速不宜过快,避免因此而压紧凝胶。但也不要过慢,使柱装得太松,导致层析过程中,凝胶床高度下降。 (4)始终保持柱内液面高于凝胶表面,否则水分挥发,凝胶变干。 (5)用此方法测蛋白质的相对分子量,受蛋白质形状的影响,并且测得的结果可能是聚合体的相对分子量,因而还需用电泳等方法进一步验证相对分子量测定结果。 思考题 1. 根据实验中遇到的各种问题,总结做好本实验的经验与教训? |