SOS-PAGE 法测定蛋白质相对分子量,目前最常用的是垂直平板不连续电泳系统。平板电泳的优点是可以将标准品和不同样品放在同一块胶上进行电泳,使之具有更好的可比性。不连续电泳与连续电泳相比的优点是可以获得较集中的区带。
原理
SOS- PAGE 法测定蛋白质相对分子量的基本原理是蛋白质在电场中支持物上的迁移率差异主要依赖于样品中各种分子携带的电荷、分子大小与形状的差别,在聚丙烯酰胺凝胶电泳系统中加入阴离子去垢剂 SOS,排除电荷、分子形状等因素(或使其作用减少到忽略不计的程度)。测定某种蛋白质的分子量,需要同时电泳分离一组标准品蛋白质,取其相对分子量的对数作为纵坐标,迁移率作为横坐标,作图得到标准工作曲线方程。将待测蛋白质的迁移率代入方程,即可计算得其相对分子量。
SOS-PAGE 法测定蛋白质相对分子量基本过程可分为如下几步:
A.标准蛋白质样品的制备
作为分子批标准的蛋白质样品目前多作为商品成套供应,常有高分子批和低分子扯标准品之分(表 10-1)。可以根据待测样品的理论分子扯或其他可参考数据选用适宜大小的蛋白质分子量标准。

B. 待测蛋白质样品的制备
取蛋白样品加入等体积的 2 x SOS-PAGE 上样缓冲液,混匀,在沸水浴中加热 3 分钟,待电泳时上样(可在分离胶聚合的间隙中制备)。
C.电泳分离及染色
应该根据待测样品的预期分子量选用适宜的标准品和聚丙烯酰胺凝胶的浓度。
D.电泳胶的制备以及蛋白质样品的电泳。
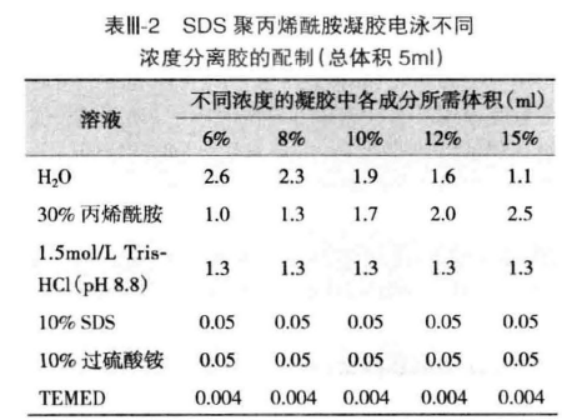
制备分离胶:根据待分离蛋白质分子量的大小,按照表 II-2 配制合适浓度的分离胶。凝胶液加入 TEMED 后立即混匀,灌入已安装好的 2 块玻璃板间隙中,留出浓缩胶所需空间(Teflon 梳齿长度再加 1cm)。用吸管沿玻璃板壁小心滴加一层水饱和正丁醇或去离子水封顶。分离胶聚合后,与覆盖液之间形成明显的分界线,倾去覆盖液,用滤纸吸干残留液体。
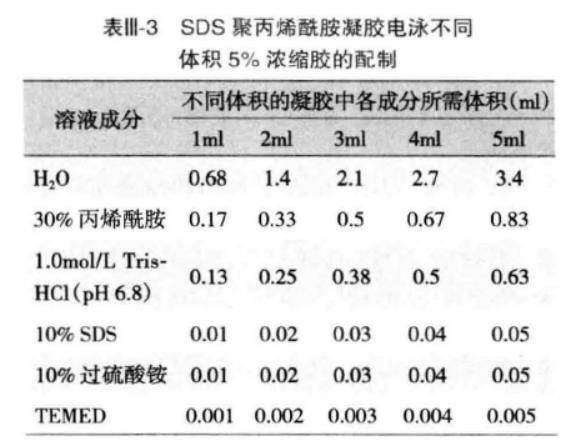
制备浓缩胶:按照表 III-3 给出的数据配制所需体积的浓缩胶。将配制好的浓缩胶溶液快速混匀后,直接灌注到已聚合的分离胶上,并立即在浓缩胶溶液中插入干净的 Teflon 梳子,避免气泡产生。浓缩胶聚合完全后,小心拔出 Teflon 梳子。将凝胶玻璃板固定于电泳装置上,放入电泳槽内,在上下槽中加入 1xTris 甘氨酸 SDS 电泳缓冲液,使电泳装置底部的电极丝浸于缓冲液中。
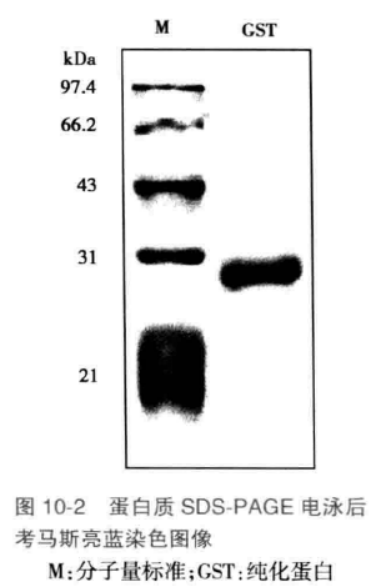
电泳: 将电泳装置的正负极与电泳仪的正负极相连,电泳时,浓缩胶电压 60V,分离胶电压 100V。当电泳前沿(溴酚蓝为指示剂)移动至胶的边缘时,结束电泳,取下胶板,切去浓缩胶,将整块分离胶浸没在 0 . 25% 考马斯亮蓝 R-250 溶液中,染色 0.5-1 小时(最好连续轻微摇动使染色均匀)。取出凝胶,用水漂洗几次,然后加入脱色液,更换数次直至显现清晰的蛋白质区带(图10-2 )。
D.蛋白质相对迁移率的计算
通常以相对迁移率Rf 表示蛋白质的泳动行为,其定义和计算方法为:Rf= 蛋白样品移动的距离(cm)÷指示染料移动的距离(cm)。指示染料移动的距离是指从分离胶起点至指示剂前沿的距离;蛋白样品移动的距离是指从分离胶电泳起始部位至蛋白质染色区带前缘间的距离。分别求得标准蛋白和样品的 Rf 后,以分子量为纵坐标,Rf 为横坐标作图,可以得到蛋白质分子量的标准曲线方程。将待测蛋白质样品的 Rf 代人方程,可计算其分子量。





![DiR' [DiIC18(7)],用于膜染色,100068-60-8,≥95%,阿拉丁](https://img1.dxycdn.com/p/s14/2024/0619/894/0610600261090733081.jpg!wh200)





